题目内容
5.乙醇催化氧化为乙醛过程中化学键的断裂与形成情况可表示如图: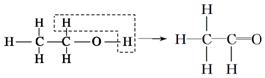
下列醇能被氧化为醛类化合物的是( )
| A. | 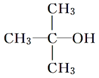 | B. |  | C. | 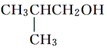 | D. | 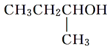 |
分析 如果醇能被氧化为醛类化合物时,与羟基相连的碳原子上至少有2个氢原子,据此分析.
解答 解:A. 中与羟基相连的碳原子上没有氢原子,不能被氧化生成醛类,故A不选;
中与羟基相连的碳原子上没有氢原子,不能被氧化生成醛类,故A不选;
B. 中与羟基相连的碳原子上有1个氢原子,能被氧化生成酮,不能被氧化生成醛类,故B不选;
中与羟基相连的碳原子上有1个氢原子,能被氧化生成酮,不能被氧化生成醛类,故B不选;
C.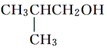 中与羟基相连的碳原子上有2个氢原子,能被氧化生成醛类,故C选;
中与羟基相连的碳原子上有2个氢原子,能被氧化生成醛类,故C选;
D.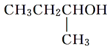 中与羟基相连的碳原子上有1个氢原子,能被氧化生成酮,不能被氧化生成醛类,故D不选;
中与羟基相连的碳原子上有1个氢原子,能被氧化生成酮,不能被氧化生成醛类,故D不选;
故选:C.
点评 本题考查了醇催化氧化的规律,掌握有机物的结构特点和反应类型,尤其是共价键的断裂方式是解题关键,题目难度不大.

练习册系列答案
相关题目
15. 在100℃时,将0.100mol的四氧化二氨气体充入1L恒容抽空的密闭容器中,隔一定时间对该容器内的物质浓度进行分析得到表数据:
在100℃时,将0.100mol的四氧化二氨气体充入1L恒容抽空的密闭容器中,隔一定时间对该容器内的物质浓度进行分析得到表数据:
(1)该反应的平衡常数表达式为$\frac{{c}^{2}(N{O}_{2})}{c({N}_{2}{O}_{4})}$;从表中数据分析:c1<c2;(填“>”“<”或“=”).
(2)在图中画出并标明此反应中N2O4和NO2的浓度随时间变化的曲线.
(3)在上述条件下,从反应开始至达到化学平衡时,四氧化二氮的平均反应速率为0.001mol•L-1•s-1.
(4)随温度升高,混合气体的颜色变深,反应的△H>0(填“大于”“小于”)
(5)达平衡后下列条件的改变可使NO2气体浓度增大的是B.
A.增大容器的容积B.再充入一定量的N2O4C.分离出一定量的NO2D.再充入一定量的He
(6)若起始时充入NO2气体0.080mol,N2O4气体0.010mol,通过计算判断反应进行的方向.
 在100℃时,将0.100mol的四氧化二氨气体充入1L恒容抽空的密闭容器中,隔一定时间对该容器内的物质浓度进行分析得到表数据:
在100℃时,将0.100mol的四氧化二氨气体充入1L恒容抽空的密闭容器中,隔一定时间对该容器内的物质浓度进行分析得到表数据:| 时间(s) | 0 | 20 | 40 | 60 | 80 |
| c(N2O4)/mol•L-1 | 0.100 | c1 | 0.050 | 0.040 | 0.040 |
| c(NO2)/mol•L-1 | 0.000 | 0.060 | c2 | 0.120 | 0.120 |
(2)在图中画出并标明此反应中N2O4和NO2的浓度随时间变化的曲线.
(3)在上述条件下,从反应开始至达到化学平衡时,四氧化二氮的平均反应速率为0.001mol•L-1•s-1.
(4)随温度升高,混合气体的颜色变深,反应的△H>0(填“大于”“小于”)
(5)达平衡后下列条件的改变可使NO2气体浓度增大的是B.
A.增大容器的容积B.再充入一定量的N2O4C.分离出一定量的NO2D.再充入一定量的He
(6)若起始时充入NO2气体0.080mol,N2O4气体0.010mol,通过计算判断反应进行的方向.
16.下列各组离子在给定条件下一定能大量共存的是( )
| A. | 滴加甲基橙显红色的溶液中:Na+、K+、Cl-、ClO- | |
| B. | 滴入KSCN显血红色的溶液中:Na+、Mg2+、SO42-、Br- | |
| C. | $\frac{c(O{H}^{-})}{c({H}^{+})}$=1.0×1012mol/L的溶液中:K+、Na+、NO3-、HCO3- | |
| D. | 由水电离的c(H+)=1.0×10-13mol/L的溶液中:NH4+、Fe2+、NO3-、SO42- |
13.硼氢化钠(NaBH4)在无机合成和有机合成中常用做还原剂.是因为硼氢化钠具有较强 的还原性,能够将羰基选择还原成羟基,但是与碳碳双键、叁键都不发生反应.在酸性条 件下不能稳定存在,但可以在中性或碱性条件下稳定存在,下面有关硼氢化钠说法中正确的是( )
| A. | 和 NaOH 含有相同类型的化学键 | |
| B. | 具有还原性是因为其中的钠元素还原性强 | |
| C. | 熔融状态的硼氢化钠能导电 | |
| D. | 硼氢化钠与盐酸混合:NaBH4+HCl+3H2O═H3BO3+NaCl+4H2↑ |
10.书法离不开文房四宝(笔、墨、纸、砚),做笔用的狼毫,研墨用的墨条以及宣纸(即白纸)和做砚台用的砚石的主要成分依次是( )
| A. | 蛋白质、炭黑、多糖、无机盐 | B. | 塑料、煤炭、多糖、无机盐 | ||
| C. | 多糖、炭黑、蛋白质、无机盐 | D. | 蛋白质、煤炭、多糖、有机玻璃 |
17.以下物质:①甲烷、②2-丁炔、③顺-2-丁烯、④环己烯、⑤环己烷、⑥苯、⑦聚苯乙烯、⑧邻二甲苯,既能使高锰酸钾酸性溶液褪色,又能使溴的四氯化碳溶液因反应而褪色的是( )
| A. | ①③⑤ | B. | ②③④ | C. | ②③④⑦ | D. | ④⑦⑧ |
5.用NA表示阿伏加德罗常数,下列说法正确的是( )
| A. | 1L1mol•L-1的FeCl3溶液中Fe3+的数目为NA | |
| B. | 32g甲烷中含有2NA个C-H键 | |
| C. | 1molNH2-含有10NA个电子 | |
| D. | 1molNa2O2与足量CO2反应.转移电子数为2NA |
 正确认识和使用电池有利于我们每一个人的日常生活.电化学处理 SO2 是目前 研究的热点,利用双氧水氧化吸收 SO2 是目前研究的热点.
正确认识和使用电池有利于我们每一个人的日常生活.电化学处理 SO2 是目前 研究的热点,利用双氧水氧化吸收 SO2 是目前研究的热点.