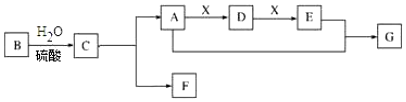
题目内容
13.设NA表示阿伏加德罗常数的数值,下列说法正确的是( )| A. | 将1 molNH3通入水中得到1L溶液,则NH4+与NH3•H2O粒子总数为NA | |
| B. | 1.2 g NaHSO4晶体中含有离子总数为0.03 NA | |
| C. | 标准状况下,2.24 L SO3含有的分子数为0.1 NA | |
| D. | 14 g乙烯和环丙烷(C3H6)混合气体中的碳原子数为NA |
分析 A、氨气和水的反应为可逆反应;
B、求出1.2 g NaHSO4晶体的物质的量,然后根据 NaHSO4晶体由钠离子和硫酸氢根离子构成来分析;
C、标况下三氧化硫为固体;
D、乙烯和环丙烷的最简式均为CH2.
解答 解:A、氨气和水的反应为可逆反应,不能进行彻底,故溶液中NH3、NH4+与NH3•H2O粒子总数为NA,故A错误;
B、1.2 g NaHSO4晶体的物质的量为0.01mol,而NaHSO4晶体由钠离子和硫酸氢根离子构成,故0.01mol晶体中含0.02NA个离子,故B错误;
C、标况下三氧化硫为固体,不能根据气体摩尔体积来计算其物质的量,故C错误;
D、乙烯和环丙烷的最简式均为CH2,故14g混合物中含有的CH2的物质的量为1mol,故含NA个碳原子,故D正确.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,难度不大,应注意掌握公式的运用和物质的结构.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
13.硼氢化钠(NaBH4)在无机合成和有机合成中常用做还原剂.是因为硼氢化钠具有较强 的还原性,能够将羰基选择还原成羟基,但是与碳碳双键、叁键都不发生反应.在酸性条 件下不能稳定存在,但可以在中性或碱性条件下稳定存在,下面有关硼氢化钠说法中正确的是( )
| A. | 和 NaOH 含有相同类型的化学键 | |
| B. | 具有还原性是因为其中的钠元素还原性强 | |
| C. | 熔融状态的硼氢化钠能导电 | |
| D. | 硼氢化钠与盐酸混合:NaBH4+HCl+3H2O═H3BO3+NaCl+4H2↑ |
18.资料显示“O2的氧化性随溶液pH的增大逐渐减弱”.某兴趣小组探究不同条件下KI与O2的反应.实验如下.
(1)实验②中生成I2的离子方程式是4I-+O2+4H+=2I2+2H2O.
(2)实验③的目的是验证Cl-是否影响KI与O2的反应.
(3)实验④比②溶液颜色浅的原因是其他条件相同时,CH3COOH是弱电解质,溶液中c(H+)较盐酸小,O2的氧化性减弱.
(4)为进一步探究KI与O2的反应,用上表中的装置继续进行实验:
I.对于实验⑥的现象.甲同学提出猜想“pH=10时O2不能氧化I-”,设计了下列装置进行实验,验证猜想.
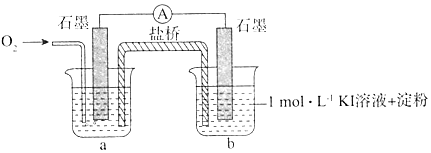
i.烧杯a中的溶液为pH=10的KOH溶液.
ii.实验结果表明,此猜想不成立.支持该结论的实验现象是:通入O2后,电流表指针偏转,烧杯b的溶液颜色变深.
Ⅱ.乙同学向pH=10的KOH溶液(含淀粉)中滴加碘水,溶液先变蓝后迅速褪色.经检测褪色后的溶液中含有IO3-,褪色的原因是(用离子方程式表示)3I2+6OH-=IO3-+5I-+3H2O.
(5)该小组同学对实验过程进行了整体反恩.推测实验①的现象产生的原因可能是中性条件下,O2的氧化性比较弱,该反应速率慢,短时间内难以生成“一定量”碘单质使溶液颜色发生变化;实验⑥的现象产生的原因可能是pH=10的KOH溶液中I-被氧化生成I2,I2迅速发生歧化反应变为IO3-和I-.
| 装置 | 烧杯中的液体 | 现象(5分钟后) |
 | ①2mL1mol/LKl溶液+5滴淀粉 | 无明显变化 |
| ②2mL1mol/LKl溶液+5滴淀粉+2mL0.2mol/L HCl | 溶液变蓝 | |
| ③2mL1mol/LKl溶液+5滴淀粉+2mL0.2mol/L KCl | 无明显变化 | |
| ④2mL1mol/LKl溶液+5滴淀粉+2mL0.2mol/L CH3COOH | 溶液变蓝,颜色较②浅 |
(2)实验③的目的是验证Cl-是否影响KI与O2的反应.
(3)实验④比②溶液颜色浅的原因是其他条件相同时,CH3COOH是弱电解质,溶液中c(H+)较盐酸小,O2的氧化性减弱.
(4)为进一步探究KI与O2的反应,用上表中的装置继续进行实验:
| 烧杯中的液体 | 现象(5小时后) |
| ⑤2mLpH=8.5混有KOH的1mol/L KI溶液+5滴淀粉 | 溶液才略变蓝 |
| ⑥2mLpH=10混有KOH的1mol/L KI溶液+5滴淀粉 | 无明显变化 |

i.烧杯a中的溶液为pH=10的KOH溶液.
ii.实验结果表明,此猜想不成立.支持该结论的实验现象是:通入O2后,电流表指针偏转,烧杯b的溶液颜色变深.
Ⅱ.乙同学向pH=10的KOH溶液(含淀粉)中滴加碘水,溶液先变蓝后迅速褪色.经检测褪色后的溶液中含有IO3-,褪色的原因是(用离子方程式表示)3I2+6OH-=IO3-+5I-+3H2O.
(5)该小组同学对实验过程进行了整体反恩.推测实验①的现象产生的原因可能是中性条件下,O2的氧化性比较弱,该反应速率慢,短时间内难以生成“一定量”碘单质使溶液颜色发生变化;实验⑥的现象产生的原因可能是pH=10的KOH溶液中I-被氧化生成I2,I2迅速发生歧化反应变为IO3-和I-.
5.用NA表示阿伏加德罗常数,下列说法正确的是( )
| A. | 1L1mol•L-1的FeCl3溶液中Fe3+的数目为NA | |
| B. | 32g甲烷中含有2NA个C-H键 | |
| C. | 1molNH2-含有10NA个电子 | |
| D. | 1molNa2O2与足量CO2反应.转移电子数为2NA |
2.下列化学用语正确的是( )
| A. | 聚丙烯的结构简式为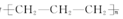 | B. | 丙烷分子的比例模型为 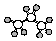 | ||
| C. | 四氯化碳分子的电子式为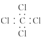 | D. | 2-乙基-1,3-丁二烯的键线式: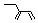 |