题目内容
17.汽车铅蓄电池总反应:Pb+PbO2+2H3SO4═2PbSO4↓+2H3O,有关说法不正确的是( )| A. | Pb 为负极,发生还原反应 | |
| B. | 放电过程,正负极质量均增重 | |
| C. | 导线中每通过 1mole-,溶液中减少 2molH+ | |
| D. | 电子由 Pb 经外电路流向 PbO3 |
分析 由总方程式可知,为原电池时,Pb为负极,发生氧化反应,电极方程式为Pb+SO42--2e-=PbSO4,PbO2为正极,发生还原反应,电极方程式为PbO2+4H++SO42--2e-=2H2O+PbSO4,以此解答该题.
解答 解:A.由总方程式可知,为原电池时,Pb为负极,发生氧化反应,故A错误;
B.正极上二氧化铅得电子发生还原反应,电极反应式为PbO2+4H++SO42-+2e-=PbSO4(s)+2H2O,所以正极质量增加,故B正确;
C.由电极PbO2+4H++SO42-+2e-=PbSO4(s)+2H2O方程式可知,导线中每通过 2mole-,溶液中减少4molH+,所以导线中每通过 1mole-,溶液中减少 2molH+,故C正确;
D.电子由负极沿导线流向正极,所以电子由 Pb 经外电路流向 PbO2,故D正确;
故选A.
点评 本题考查原电池和电解池知识,侧重于学生的分析能力和电化学知识的综合考查,为高考常见题型和高频考点,注意把握电解方程式的书写,难度不大.

练习册系列答案
相关题目
17.以下物质:①甲烷、②2-丁炔、③顺-2-丁烯、④环己烯、⑤环己烷、⑥苯、⑦聚苯乙烯、⑧邻二甲苯,既能使高锰酸钾酸性溶液褪色,又能使溴的四氯化碳溶液因反应而褪色的是( )
| A. | ①③⑤ | B. | ②③④ | C. | ②③④⑦ | D. | ④⑦⑧ |
5.用NA表示阿伏加德罗常数,下列说法正确的是( )
| A. | 1L1mol•L-1的FeCl3溶液中Fe3+的数目为NA | |
| B. | 32g甲烷中含有2NA个C-H键 | |
| C. | 1molNH2-含有10NA个电子 | |
| D. | 1molNa2O2与足量CO2反应.转移电子数为2NA |
12.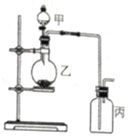 利用如图所示装置进行实验,能实现实验目的是(必要时可加热)( )
利用如图所示装置进行实验,能实现实验目的是(必要时可加热)( )
 利用如图所示装置进行实验,能实现实验目的是(必要时可加热)( )
利用如图所示装置进行实验,能实现实验目的是(必要时可加热)( )| 选项 | 实验目的 | 甲 | 乙 | 丙 |
| A | 制取并收集NO2 | 浓硝酸 | 铜片 | 水 |
| B | 制取并验证SO2具有漂白性 | 70%硫酸 | 亚硫酸钠 | 品红溶液 |
| C | 制取并验证氯气没有漂白性 | 浓盐酸 | 二氧化锰 | 干燥的红布条 |
| D | 比较HCl、H2CO3和H2SiO3酸性的强弱 | 盐酸 | 大理石 | 硅酸钠溶液 |
| A. | A | B. | B | C. | C | D. | D |
2.下列化学用语正确的是( )
| A. | 聚丙烯的结构简式为 | B. | 丙烷分子的比例模型为  | ||
| C. | 四氯化碳分子的电子式为 | D. | 2-乙基-1,3-丁二烯的键线式: |
6.下列变化过程中,共价键被破坏的是( )
| A. | 冰融化成水 | B. | 氯气溶于水 | C. | 氯化钠熔化 | D. | 酒精溶于水 |
11.下列说法正确的是( )
| A. | 氯气和明矾都能用于自来水的杀菌消毒 | |
| B. | 常温下,浓硫酸和浓硝酸都能用铜制容器盛装 | |
| C. | 钢铁设备连接锌块或电源正极都可防止其腐蚀 | |
| D. | 酸雨主要是由人为排放的硫氧化物和氮氧化物等转化而成 |
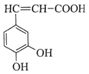 咖啡酸(如图)存在于野胡萝卜、光叶水苏、荞麦等物中.咖 啡酸有止血作用,特别对内脏的止血效果较好.A是咖啡酸的同分异构体,其苯环上只有1个取代基,1molA能与2molNaHCO3反应,A的结构简式C6H5CH(COOH)2.
咖啡酸(如图)存在于野胡萝卜、光叶水苏、荞麦等物中.咖 啡酸有止血作用,特别对内脏的止血效果较好.A是咖啡酸的同分异构体,其苯环上只有1个取代基,1molA能与2molNaHCO3反应,A的结构简式C6H5CH(COOH)2.