题目内容
17.学生做如下实验:第一步,在淀粉KI溶液中,滴入少量NaClO溶液,并加入少量稀硫酸,溶液立即变蓝;第二步,在上述蓝色溶液中,滴加足量的Na2SO3溶液,蓝色逐渐消失.下列叙述中该同学对实验原理的解释和所得结论不正确的是( )| A. | 氧化性:ClO->I2>SO42- | |
| B. | 蓝色消失的原因是Na2SO3溶液反应生成SO2具有漂白性 | |
| C. | 淀粉KI溶液变蓝是因为I-被ClO-氧化为I2,I2遇淀粉变蓝 | |
| D. | 若将Na2SO3溶液加入溴水,溴水褪色 |
分析 第一步中发生:NaClO+2KI+H2SO4═I2+NaCl+K2SO4+H2O,第二步发生:Na2SO3+I2+H2O═Na2SO4+2HI,均为氧化还原反应,结合物质的性质及氧化剂的氧化性大于氧化产物的氧化性来解答.
解答 解:A.由NaClO+2KI+H2SO4═I2+NaCl+K2SO4+H2O,ClO-的氧化性大于I2的氧化性,由Na2SO3+I2+H2O═Na2SO4+2HI,I2的氧化性大于SO4 2-的氧化性,所以氧化性强弱为:ClO->I2>SO42-,故A正确;
B.由第二步反应可知,S元素的化合价升高,则蓝色消失的原因是Na2SO3溶液具有还原性,故B错误;
C.由第一步反应可知,淀粉KI溶液变蓝是因为I-被氧化为I2,淀粉遇I2变蓝,故C正确;
D.单质溴的氧化性强于碘单质,碘单质将亚硫酸钠氧化为硫酸钠,所以单质溴也能将亚硫酸钠氧化,而使溴水褪色,故D正确;
故选:B.
点评 本题以卤族元素及化合物的性质考查氧化还原反应,把握发生的化学反应为解答的关键,注意利用氧化还原反应中的规律性知识来解答,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
8.下列各组性质比较中,正确的是( )
①酸性:HClO4>HBrO4>HIO4②碱性:Ba(OH)2>Mg(OH)2>Be(OH)2③非金属性:F>C>O
④金属性性:Al<Mg<Na ⑤气态氢化物稳定性:HF>HCl>H2S.
①酸性:HClO4>HBrO4>HIO4②碱性:Ba(OH)2>Mg(OH)2>Be(OH)2③非金属性:F>C>O
④金属性性:Al<Mg<Na ⑤气态氢化物稳定性:HF>HCl>H2S.
| A. | ①②③ | B. | ②③④ | C. | ①②④⑤ | D. | ①②③④⑤ |
2.下列金属冶炼的说法错误的是( )
| A. | 铝热反应是冶炼难熔金属的方法之一 | |
| B. | 铝热剂是混合物 | |
| C. | 活泼金属的冶炼常用电解方法,如电解NaCl溶液就可制备Na | |
| D. | 湿法炼铜的原理是 Fe+CuSO4=Cu+FeSO4 |
9.下列反应是放热反应的是( )
| A. | 铝粉与盐酸反应 | B. | 浓硫酸溶于水 | ||
| C. | 碳酸钙受热分解 | D. | NH4Cl与Ba(OH)2•8H2O反应 |
7.下列化学用语表示正确的是( )
| A. | CO2分子的球棍模型: | |
| B. | COCl2的电子式: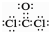 | |
| C. | 质子数为6、质量数为14的原子:${\;}_{6}^{14}$N | |
| D. | 熔融状态下硫酸氢钾的电离方程式:KHSO4(熔融)→K++H++SO4- |
 (用电子式表示).
(用电子式表示). 人胃酸(主要成分是盐酸)过多,会引起很多胃病.下图为某抗酸药包装标签上的部分文字,请回答下列问题.
人胃酸(主要成分是盐酸)过多,会引起很多胃病.下图为某抗酸药包装标签上的部分文字,请回答下列问题.