题目内容
9.下列反应是放热反应的是( )| A. | 铝粉与盐酸反应 | B. | 浓硫酸溶于水 | ||
| C. | 碳酸钙受热分解 | D. | NH4Cl与Ba(OH)2•8H2O反应 |
分析 根据常见的放热反应有:所有的物质燃烧、所有金属与酸反应、金属与水反应,所有中和反应;绝大多数化合反应和铝热反应;
常见的吸热反应有:绝大数分解反应,个别的化合反应(如C和CO2),少数分解置换以及某些复分解(如铵盐和强碱).
解答 解:A、金属和酸的反应为放热反应,故铝粉和盐酸的反应放热,故A正确;
B、浓硫酸溶于水不是反应,只是放热的物理过程,故B错误;
C、绝大多数的分解反应为吸热反应,故碳酸钙的分解为吸热反应,故C错误;
D、铵盐和碱的反应吸热,故NH4Cl与Ba(OH)2•8H2O的反应为吸热反应,故D错误.
故选A.
点评 本题考查放热反应,难度不大,掌握中学化学中常见的吸热或放热的反应是解题的关键.

练习册系列答案
相关题目
17.学生做如下实验:第一步,在淀粉KI溶液中,滴入少量NaClO溶液,并加入少量稀硫酸,溶液立即变蓝;第二步,在上述蓝色溶液中,滴加足量的Na2SO3溶液,蓝色逐渐消失.下列叙述中该同学对实验原理的解释和所得结论不正确的是( )
| A. | 氧化性:ClO->I2>SO42- | |
| B. | 蓝色消失的原因是Na2SO3溶液反应生成SO2具有漂白性 | |
| C. | 淀粉KI溶液变蓝是因为I-被ClO-氧化为I2,I2遇淀粉变蓝 | |
| D. | 若将Na2SO3溶液加入溴水,溴水褪色 |
1.通过下列实验可以得出的结论,其中不合理的是( )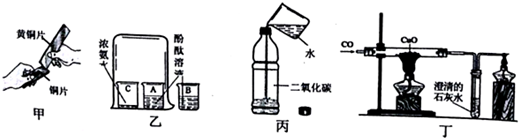

| A. | 甲实验中黄铜片能在铜片上刻画出痕迹可以说明黄铜的硬度比铜片大 | |
| B. | 乙实验既可以说明分子在不停的运动着,又可以说明氨水显碱性 | |
| C. | 丙实验既可以说明二氧化碳易溶于水,又可以说明二氧化碳具有酸性 | |
| D. | 丁实验既可以说明一氧化碳具有还原性,又可以说明一氧化碳具有可燃性 |
19.有如下转化关系:
甲+强酸→盐+气体+H2O,则甲不可能是( )
甲+强酸→盐+气体+H2O,则甲不可能是( )
| A. | Na2O2 | B. | Cu | C. | Fe | D. | Si |
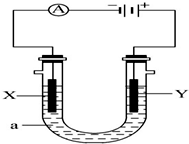 电解原理在化学工业中有广泛应用.如图表示一个电解池,X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞溶液,请回答以下问题:
电解原理在化学工业中有广泛应用.如图表示一个电解池,X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞溶液,请回答以下问题: