题目内容
5.有FeSO4、Fe(NO3)3、Fe2(SO4)3、HNO3、N2O、H2O六种物质,分别属于一个氧化还原反应中的反应物和生成物,请写出该反应的化学方程式30HNO3+24FeSO4=8Fe(NO3)3+8Fe2(SO4)3+3N2O↑+15H2O.分析 HNO3为反应物,具有强氧化性,则N2O为生成物,反应中硝酸被还原,为氧化剂,则反应中FeSO4应为还原剂,被氧化生成Fe(NO3)3和Fe2(SO4)3,根据得失电子守恒以及元素守恒书写方程式.
解答 解:氧化还原反应的特征为化合价的升降,反应中HNO3为反应物,具有强氧化性,则N2O为生成物,反应中硝酸被还原,为氧化剂,题给物质中元素化合价发生变化的还有Fe,则Fe元素化合价应升高,被氧化,则FeSO4应为还原剂,被氧化生成Fe(NO3)3和Fe2(SO4)3,根据电子守恒,氮元素的化合价降低了4价,铁元素化合价升高了1价,根据得失电子守恒以及元素守恒,最小公倍数为24,所以硫酸亚铁前边系数是24,硝酸前系数是,30,水的前边系数是15,化学方程式为:30HNO3+24FeSO4=8Fe(NO3)3+8Fe2(SO4)3+3N2O↑+15H2O,
故答案为:30HNO3+24FeSO4=8Fe(NO3)3+8Fe2(SO4)3+3N2O↑+15H2O.
点评 本题综合考查氧化还原反应,为高考常见题型,侧重于学生的分析能力考查,注意从元素化合价的角度分析氧化还原反应的相关概念和物质的性质,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
15.下列反应的产物中,其中存在同分异构体的反应是( )
| A. | 2-丁烯与HBr发生加成反应 | |
| B. | 3-氯戊烷与NaOH乙醇溶液共热发生消去反应 | |
| C. | 甲苯在一定条件下发生溴代反应生成一溴代甲苯的反应 | |
| D. | 邻羟基苯甲酸与NaHCO3溶液反应 |
16.已知浓硫酸和木炭粉在加热条件下可发生化学反应.
(1)上述反应的化学方程式为2H2SO4(浓)+C$\frac{\underline{\;\;△\;\;}}{\;}$2SO2↑+CO2↑+2H2O.
(2)试用如图所列各装置设计一个实验,来验证上述反应所产生的各种产物.
这些装置的连接顺序(按产物气流从左至右的方向)是(填装置中导管口的编号):
g接c,d接a,b接f.
(3)实验时可观察到装置①中A瓶中的溶液褪色,C瓶中的溶液不褪色.A瓶中的溶液的作用是检验SO2气体;B瓶中的溶液的作用是吸收SO2气体;C瓶中的溶液的作用是检验SO2气体是否除干净.
(4)装置②中所加固体药品是无水硫酸铜.可验证的产物是H2O.
(5)装置③中所盛溶液是澄清石灰水,可验证的产物是CO2.
(1)上述反应的化学方程式为2H2SO4(浓)+C$\frac{\underline{\;\;△\;\;}}{\;}$2SO2↑+CO2↑+2H2O.
(2)试用如图所列各装置设计一个实验,来验证上述反应所产生的各种产物.
| 编号 | ① | ② | ③ | ④ |
| 装置 |  |  |  |  |
g接c,d接a,b接f.
(3)实验时可观察到装置①中A瓶中的溶液褪色,C瓶中的溶液不褪色.A瓶中的溶液的作用是检验SO2气体;B瓶中的溶液的作用是吸收SO2气体;C瓶中的溶液的作用是检验SO2气体是否除干净.
(4)装置②中所加固体药品是无水硫酸铜.可验证的产物是H2O.
(5)装置③中所盛溶液是澄清石灰水,可验证的产物是CO2.
13.下列实验操作能达到实验目的是( )
| A. | 将NaOH浓溶液滴加到饱和FeCl3溶液中制备Fe(OH)3胶体 | |
| B. | 用向上排空气法收集铜粉与稀硝酸反应产生的NO | |
| C. | 配制氯化铁溶液时,将氯化铁溶解在较浓的盐酸中再加水稀释 | |
| D. | 将Cl2与HCl混合气体通过饱和食盐水可得到纯净的Cl2 |
10.下列有机物中属于醇的是( )
| A. | HOCHO | B. | CH3OH | C. | CH3OCH3 | D. | CH3COOH |
17.学生做如下实验:第一步,在淀粉KI溶液中,滴入少量NaClO溶液,并加入少量稀硫酸,溶液立即变蓝;第二步,在上述蓝色溶液中,滴加足量的Na2SO3溶液,蓝色逐渐消失.下列叙述中该同学对实验原理的解释和所得结论不正确的是( )
| A. | 氧化性:ClO->I2>SO42- | |
| B. | 蓝色消失的原因是Na2SO3溶液反应生成SO2具有漂白性 | |
| C. | 淀粉KI溶液变蓝是因为I-被ClO-氧化为I2,I2遇淀粉变蓝 | |
| D. | 若将Na2SO3溶液加入溴水,溴水褪色 |
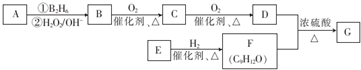
 ;该反应的反应类型为取代反应或酯化反应
;该反应的反应类型为取代反应或酯化反应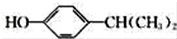 .
.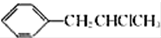 为原料也可合成F,请参考题目中的相关信息写出相应的合成路线图(反应条件中的试剂写在箭头上方,其他写在箭头下方):
为原料也可合成F,请参考题目中的相关信息写出相应的合成路线图(反应条件中的试剂写在箭头上方,其他写在箭头下方):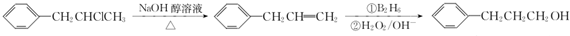 .
.