题目内容
2.下列离子方程式的书写正确的是( )| A. | 硫化钠水解:S2-+2H2O?H2S↑+2OH- | |
| B. | 硫氢化钠水解:HS-+H2O?H3O++S2- | |
| C. | 硫化钾水解:S2-+H2O?HS-+OH- | |
| D. | 硫酸铝溶液跟碳酸氢钠溶液反应:Al3++3HCO3-+6H2O?Al(OH)3↓+3CO2↑ |
分析 A.硫离子为二元弱酸酸根离子,分步水解,以第一步为主;
B.硫氢根离子水解生成硫化氢和氢氧根离子;
C.硫离子为二元弱酸酸根离子,分步水解,以第一步为主;
D.铝离子跟碳酸氢根离子发生复分解反应生成氢氧化铝和二氧化碳;
解答 解:A.硫化钠水解,离子方程式:S2-+2H2O?HS-+OH-,故A错误;
B.硫氢根离子水解生成硫化氢和氢氧根离子,离子方程式:HS-+H2O?HS-+OH-,故B错误;
C.硫化钾水解,离子方程式:S2-+H2O?HS-+OH-,故C正确;
D.硫酸铝溶液跟碳酸氢钠溶液反应:Al3++3HCO3-?Al(OH)3↓+3CO2↑,故D错误;
故选:C.
点评 本题考查了离子方程式的书写,主要涉及盐类的水解离子方程式的书写,注意二元弱酸酸根离子分步水解,题目难度不大.

练习册系列答案
相关题目
10.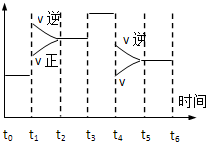 密闭体系中发生下列反应N2(g)+3H2(g)?2NH3 △H<0,如图是某一时间段中反应速率与反应进程的曲线关系图,下列各时间段内,氮气的百分含量最高的是( )
密闭体系中发生下列反应N2(g)+3H2(g)?2NH3 △H<0,如图是某一时间段中反应速率与反应进程的曲线关系图,下列各时间段内,氮气的百分含量最高的是( )
 密闭体系中发生下列反应N2(g)+3H2(g)?2NH3 △H<0,如图是某一时间段中反应速率与反应进程的曲线关系图,下列各时间段内,氮气的百分含量最高的是( )
密闭体系中发生下列反应N2(g)+3H2(g)?2NH3 △H<0,如图是某一时间段中反应速率与反应进程的曲线关系图,下列各时间段内,氮气的百分含量最高的是( )| A. | t0~t1 | B. | t2~t3 | C. | t3~t4 | D. | t5~t6 |
17.在6KOH+3Cl2═KClO3+5KCl+3H2O的反应中,下列说法中正确的是( )
| A. | Cl2是氧化剂,KOH是还原剂 | |
| B. | KOH是氧化剂,Cl2是还原剂 | |
| C. | KCl是还原产物,KClO3是氧化产物 | |
| D. | 被氧化的氯原子与被还原的氯原子数之比为5:1 |
14.下列不属于同分异构体的组合是:( )
| A. | 戊烷与乙烷 | B. | 淀粉和纤维素 | C. |  | D. | CH3CH2CH2CH3和 |
10.在一定温度下,当Mg(OH)2固体在水溶液中达到下列平衡时:Mg(OH)2?Mg2++2OH-,要使Mg(OH)2固体减少而c(Mg2+)不变,可采取的措施是( )
| A. | 加MgSO4 | B. | 加HCl溶液 | C. | 加NaOH | D. | 加少量水 |
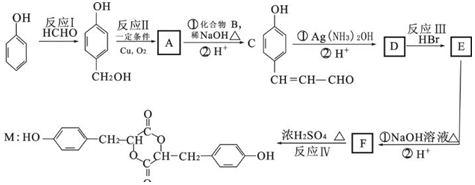
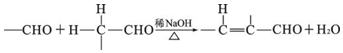
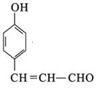 +2Ag(NH3)2OH$\stackrel{△}{→}$
+2Ag(NH3)2OH$\stackrel{△}{→}$ +2Ag↓+3NH3+H2O
+2Ag↓+3NH3+H2O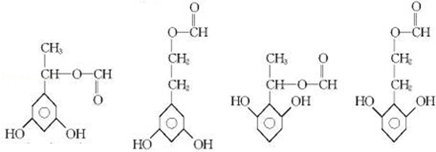 种.
种.