题目内容
3.车用妄全气囊中反应方程式为BNaN3=2Na+3N2↑,用双桥线标出电子 转移的数目和变化类型,指出氧化剂和还原剂.若要得到标准状况下33.6LN2,需要多少克NaN3(写出计算过程),NaN3的密度约为2g/cm3,则NaN3的体积约为多少立方厘米.分析 2NaN3=2Na+3N2↑,Na由+1价降低为0价得电子,N由-$\frac{1}{3}$价升高为0价失电子,转移电子数目为2e-,结合化学反应方程式进行分析解答.
解答 解:2NaN3=2Na+3N2↑,Na由+1价降低为0价得电子,N由-$\frac{1}{3}$价升高为0价失电子,转移电子数目为2e-,所以氧化剂和还原剂都是NaN3,双桥线标出电子 转移的数目为 ;
;
由2NaN3=2Na+3N2↑,若要得到标准状况下33.6LN2,设需要NaN3为xg,
则2×65 3×22.4
x 33.6
所以$\frac{2×65}{x}$=$\frac{3×22.4}{33.6}$,解得x=75g,则NaN3的体积约为$\frac{75g}{2g/cm{\;}^{3}}$=37.5立方厘米
答:氧化剂和还原剂都是NaN3,双桥线标出电子 转移的数目为 ,若要得到标准状况下33.6LN2,设需要NaN375g,体积约为37.5立方厘米.
,若要得到标准状况下33.6LN2,设需要NaN375g,体积约为37.5立方厘米.
点评 本题考查了氧化还原反应、氧化剂、还原剂的判断以及根据方程式计算,根据元素化合价是否变化来分析解答,难度不大.

练习册系列答案
 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案
相关题目
14.已知分解1mol KClO3放出热量38.8kJ,在MnO2下加热,KClO3的分解机理为:
①2KClO3+4MnO2═2KCl+2Mn2O7 慢
②2Mn2O7═4MnO2+3O2 快
下列有关说法不正确的是( )
①2KClO3+4MnO2═2KCl+2Mn2O7 慢
②2Mn2O7═4MnO2+3O2 快
下列有关说法不正确的是( )
| A. | 1 mol KClO3所具有的总能量高于1 mol KCl所具有的总能量 | |
| B. | KClO3分解速率快慢主要取决于反应① | |
| C. | 1 g KClO3,1 g MnO2,0.1 g Mn2O7混合加热,充分反应后MnO2质量为1 g | |
| D. | 将固体二氧化锰碾碎,可加快KClO3的分解速率 |
11.不能用胶体的有关知识解释的现象是( )
| A. | 盐卤或石膏加入豆浆里制成豆腐 | |
| B. | 冶金厂利用高压直流电除去大量粉尘 | |
| C. | 向FeCl3溶液中加入NaOH溶液,会出现红褐色沉淀 | |
| D. | 在河水与海水的交界处,易形成三角洲 |
18.有关溶液中所含离子的检验,下列判断正确的是( )
| A. | 加入硝酸酸化,再滴加KSCN溶液后有红色物质生成,则原溶液中一定有Fe3+存在 | |
| B. | 加入盐酸有能使澄清石灰水变浑浊的气体生成,则原溶液中一定有大量的CO32-存在 | |
| C. | 某溶液做焰色反应时火焰为黄色,则该溶液中一定有钠元素 | |
| D. | 分别含有Mg2+、Cu2+、Fe2+和Na+的四种盐溶液,只用NaOH溶液不能一次性鉴别开 |
8.对于可逆反应A(g)+3B(g)?2C(g)+2D(g),在不同条件下的化学反应速率如下,其中表示的反应速率最快的是( )
| A. | υ(A)=0.5mol/(L•min) | B. | υ(B)=0.12mol/(L•s) | C. | υ(C)=0.1mol/(L•s) | D. | υ(D)=0.4mol/(L•min) |
5.已知苯甲酸微溶于水,易溶于乙醇、乙醚,有弱酸性,酸性比醋酸强.它可用于制备苯甲酸乙酯.
制备苯甲酸乙酯的反应原理
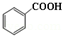 +C2H5OH$\stackrel{H_{2}SO_{4}}{?}$
+C2H5OH$\stackrel{H_{2}SO_{4}}{?}$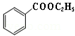 +H2O
+H2O
相关物质的部分物理性质如表格:
实验流程如图1:
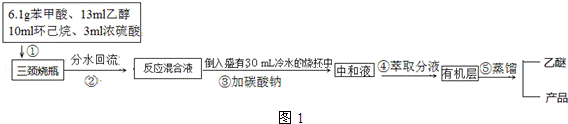
(1)制备苯甲酸乙酯,图2装置最合适的是B,反应液中的环己烷在本实验中的作用带出生成的水,促进酯化反应向正向进行.
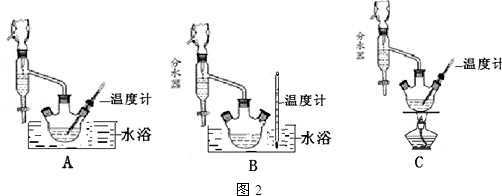
(2)步骤②控制温度在65~70℃缓慢加热液体回流,分水器中逐渐出现上、下两层液体,直到反应完成,停止加热.放出分水器中的下层液体后,继续加热,蒸出多余的乙醇和环己烷.
反应完成的标志是分水器中下层(水层)液面不再升高.
(3)步骤③碳酸钠的作用是中和苯甲酸和硫酸,碳酸钠固体需搅拌下分批加入的原因加入过快大量泡沫的产生可使液体溢出.
(4)步骤④将中和后的液体转入分液漏斗分出有机层,水层用25mL乙醚萃取,然后合并至有机层,用无水MgSO4干燥.乙醚的作用萃取出水层中溶解的苯甲酸乙酯,提高产率.
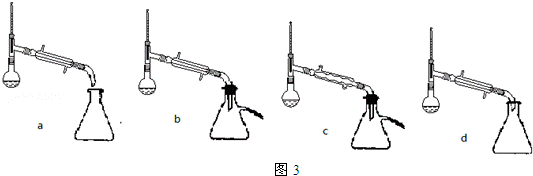
(5)步骤⑤蒸馏操作中,图3装置最好的是b d(填标号),蒸馏时先低温蒸出乙醚,蒸馏乙醚时最好采用水浴加热(水浴加热、直接加热、油浴加热).
(6)最终得到6.75g纯品,则苯甲酸乙酯的产率是90%.
制备苯甲酸乙酯的反应原理
 +C2H5OH$\stackrel{H_{2}SO_{4}}{?}$
+C2H5OH$\stackrel{H_{2}SO_{4}}{?}$ +H2O
+H2O相关物质的部分物理性质如表格:
| 沸点(℃) | 密度(g•cm-3) | |
| 苯甲酸 | 249 | 1.2659 |
| 苯甲酸乙酯 | 212.6 | 1.05 |
| 乙醇 | 78.5 | 0.7893 |
| 环已烷 | 80.8 | 0.7785 |
| 乙醚 | 34.51 | 0.7318 |
| 环已烷、乙醇和水共沸物 | 62.1 |

(1)制备苯甲酸乙酯,图2装置最合适的是B,反应液中的环己烷在本实验中的作用带出生成的水,促进酯化反应向正向进行.

(2)步骤②控制温度在65~70℃缓慢加热液体回流,分水器中逐渐出现上、下两层液体,直到反应完成,停止加热.放出分水器中的下层液体后,继续加热,蒸出多余的乙醇和环己烷.
反应完成的标志是分水器中下层(水层)液面不再升高.
(3)步骤③碳酸钠的作用是中和苯甲酸和硫酸,碳酸钠固体需搅拌下分批加入的原因加入过快大量泡沫的产生可使液体溢出.
(4)步骤④将中和后的液体转入分液漏斗分出有机层,水层用25mL乙醚萃取,然后合并至有机层,用无水MgSO4干燥.乙醚的作用萃取出水层中溶解的苯甲酸乙酯,提高产率.
(5)步骤⑤蒸馏操作中,图3装置最好的是b d(填标号),蒸馏时先低温蒸出乙醚,蒸馏乙醚时最好采用水浴加热(水浴加热、直接加热、油浴加热).

(6)最终得到6.75g纯品,则苯甲酸乙酯的产率是90%.
2.下列离子方程式的书写正确的是( )
| A. | 硫化钠水解:S2-+2H2O?H2S↑+2OH- | |
| B. | 硫氢化钠水解:HS-+H2O?H3O++S2- | |
| C. | 硫化钾水解:S2-+H2O?HS-+OH- | |
| D. | 硫酸铝溶液跟碳酸氢钠溶液反应:Al3++3HCO3-+6H2O?Al(OH)3↓+3CO2↑ |
3.下列叙述中正确的是( )
| A. | 金属原子失电子越多,其还原性越强 | |
| B. | 制成0.5L 1mol/L的Na2CO3溶液,需要Na2CO3•10H2O晶体质量为143克 | |
| C. | 相同条件下,NA个氧气分子和NA个氮气分子的密度比等于7:8 | |
| D. | 配制480 mL溶液时,选择规格为480 mL的容量瓶 |