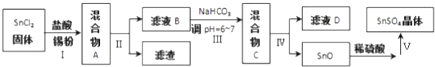
题目内容
10.在一定温度下,当Mg(OH)2固体在水溶液中达到下列平衡时:Mg(OH)2?Mg2++2OH-,要使Mg(OH)2固体减少而c(Mg2+)不变,可采取的措施是( )| A. | 加MgSO4 | B. | 加HCl溶液 | C. | 加NaOH | D. | 加少量水 |
分析 要使Mg(OH)2固体减少,应使平衡向正向移动,但c(Mg2+)不变,说明仍为饱和溶液,可加入水,以此解答该题.
解答 解:A.加入固体MgSO4,增大了c(Mg2+),使溶解平衡逆向移动,悬浊液中Mg(OH)2固体的质量增加,故A错误;
B.加适量盐酸,消耗了氢氧根离子,使溶解平衡正向移动,悬浊液中Mg(OH)2固体的质量减少,c(Mg2+)增加,故B错误;
C.加入NaOH固体,增大了c(OH-),使溶解平衡逆向移动,悬浊液中Mg(OH)2固体的质量增加,c(Mg2+)减小,故C错误;
D.加入适量水,使溶解平衡正向移动,悬浊液中Mg(OH)2固体的质量减少,由于加水后仍是Mg(OH)2的饱和溶液,所以c(Mg2+)不变,故D正确;
故选:D.
点评 本题考查难溶电解质的溶解平衡和沉淀的转化,为高频考点,侧重于学生的分析能力的考查,题目难度不大,注意从平衡移动的角度解答该题.

练习册系列答案
相关题目
2.下列离子方程式的书写正确的是( )
| A. | 硫化钠水解:S2-+2H2O?H2S↑+2OH- | |
| B. | 硫氢化钠水解:HS-+H2O?H3O++S2- | |
| C. | 硫化钾水解:S2-+H2O?HS-+OH- | |
| D. | 硫酸铝溶液跟碳酸氢钠溶液反应:Al3++3HCO3-+6H2O?Al(OH)3↓+3CO2↑ |
3.下列叙述中正确的是( )
| A. | 金属原子失电子越多,其还原性越强 | |
| B. | 制成0.5L 1mol/L的Na2CO3溶液,需要Na2CO3•10H2O晶体质量为143克 | |
| C. | 相同条件下,NA个氧气分子和NA个氮气分子的密度比等于7:8 | |
| D. | 配制480 mL溶液时,选择规格为480 mL的容量瓶 |
20.T℃时,某一气态平衡体系中含有X(g)、Y(g)、Z(g)、W(g)四种物质,此温度下发生反应的平衡常数表达式为:K=$\frac{c(X)•{c}^{2}(Y)}{{c}^{2}(Z)•{c}^{2}(W)}$,有关该平衡体系的说法正确的是( )
| A. | 升高温度,W(g)体积分数增加,则正反应是放热反应 | |
| B. | 减小X浓度,平衡向逆反应方向移动,平衡常数K减小 | |
| C. | 平衡正向移动,化学平衡常数一定增大 | |
| D. | 该反应可表示为X(g)+2Y(g)?2Z(g)+2W(g) |
5.将AgCl 和AgI 的饱和溶液相混合,在其中加入足量AgNO3 固体,将会( )
| A. | 只有AgCl 沉淀 | B. | 只有AgI 沉淀 | ||
| C. | AgCl、AgI 都沉淀,以AgCl 为主 | D. | AgCl、AgI 都沉淀,以AgI 为主 |
2.蛇纹石矿可以看做由MgO、Fe2O3、Al2O3和SiO2组成.某实验小组设计如下流程欲分别制得单质Mg、Fe、Al和Si.
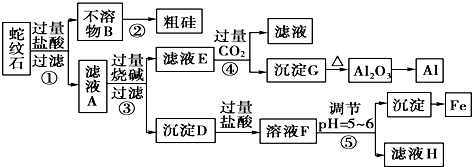
有关氢氧化物沉淀时的pH见如表:
请回答下列问题:
(1)滤液A中含有的阳离子有Fe3+、Al3+、Mg2+、H+;
(2)操作④中生成沉淀G的离子方程式为AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;
(3)由G反应生成Al2O3的反应方程式2Al(OH)3$\frac{\underline{\;\;△\;\;}}{\;}$Al2O3+3H2O;
(4)操作⑤中调节pH=5~6时,可以用到的试剂为c(填字母).
a.NaOH溶液 b.氨水 c.MgO
(5)由滤液H制取金属Mg的流程如下:
滤液H$\stackrel{加热浓缩}{→}$$\stackrel{冷却结晶}{→}$MgCl2•6MgCl2-→Mg
该流程中由MgCl2冶炼Mg的方法是电解.

有关氢氧化物沉淀时的pH见如表:
| 金属阳离子 | 氢氧化物开始沉淀时的pH | 氢氧化物完全沉淀时的pH |
| Fe3+ | 1.9 | 3.2 |
| Mg2+ | 9.4 | 11.6 |
(1)滤液A中含有的阳离子有Fe3+、Al3+、Mg2+、H+;
(2)操作④中生成沉淀G的离子方程式为AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;
(3)由G反应生成Al2O3的反应方程式2Al(OH)3$\frac{\underline{\;\;△\;\;}}{\;}$Al2O3+3H2O;
(4)操作⑤中调节pH=5~6时,可以用到的试剂为c(填字母).
a.NaOH溶液 b.氨水 c.MgO
(5)由滤液H制取金属Mg的流程如下:
滤液H$\stackrel{加热浓缩}{→}$$\stackrel{冷却结晶}{→}$MgCl2•6MgCl2-→Mg
该流程中由MgCl2冶炼Mg的方法是电解.
20.下列关于离子共存或离子反应的说法正确的是( )
| A. | 某无色溶液中可能大量存在H+、Cl-、MnO4- | |
| B. | 大量氢离子的溶液中可能大量存在Na+、NH4+、SiO32- | |
| C. | Fe2+与H2O2在酸性溶液中的反应:2Fe2++H2 O2+2H+═2Fe3++2H2O | |
| D. | 稀硫酸与Ba(OH)2溶液的反应:H++SO42-+Ba2++OH-═BaSO4↓+2H2O |