题目内容
14.下列不属于同分异构体的组合是:( )| A. | 戊烷与乙烷 | B. | 淀粉和纤维素 | C. |  | D. | CH3CH2CH2CH3和 |
分析 分子式相同、结构不同的化合物互为同分异构体,所以互为同分异构体的化合物必须满足三要素:分子式相同、结构不同、化合物,据此进行解答.
解答 解:A.戊烷与乙烷的分子式不同,二者不是同分异构体,故A错误;
B.淀粉和纤维素的分子式不同,二者不属于同分异构体,故B错误;
C. 的分子式、结构相同,为同一种物质,故C错误;
的分子式、结构相同,为同一种物质,故C错误;
D.CH3CH2CH2CH3和 的分子式相同、结构不同,二者互为同分异构体,故D正确;
的分子式相同、结构不同,二者互为同分异构体,故D正确;
故选D.
点评 本题考查了同分异构体的判断,题目难度不大,明确同分异构体的概念即可解答,B为易错点,注意淀粉和纤维素的分子式不同,试题培养了学生的灵活应用能力.

练习册系列答案
相关题目
14.已知分解1mol KClO3放出热量38.8kJ,在MnO2下加热,KClO3的分解机理为:
①2KClO3+4MnO2═2KCl+2Mn2O7 慢
②2Mn2O7═4MnO2+3O2 快
下列有关说法不正确的是( )
①2KClO3+4MnO2═2KCl+2Mn2O7 慢
②2Mn2O7═4MnO2+3O2 快
下列有关说法不正确的是( )
| A. | 1 mol KClO3所具有的总能量高于1 mol KCl所具有的总能量 | |
| B. | KClO3分解速率快慢主要取决于反应① | |
| C. | 1 g KClO3,1 g MnO2,0.1 g Mn2O7混合加热,充分反应后MnO2质量为1 g | |
| D. | 将固体二氧化锰碾碎,可加快KClO3的分解速率 |
5.已知苯甲酸微溶于水,易溶于乙醇、乙醚,有弱酸性,酸性比醋酸强.它可用于制备苯甲酸乙酯.
制备苯甲酸乙酯的反应原理
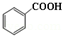 +C2H5OH$\stackrel{H_{2}SO_{4}}{?}$
+C2H5OH$\stackrel{H_{2}SO_{4}}{?}$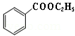 +H2O
+H2O
相关物质的部分物理性质如表格:
实验流程如图1:
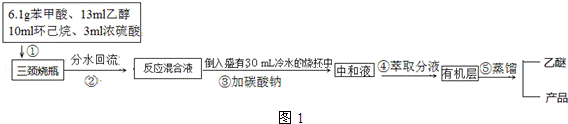
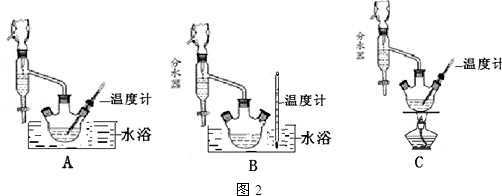
(1)制备苯甲酸乙酯,图2装置最合适的是B,反应液中的环己烷在本实验中的作用带出生成的水,促进酯化反应向正向进行.
(2)步骤②控制温度在65~70℃缓慢加热液体回流,分水器中逐渐出现上、下两层液体,直到反应完成,停止加热.放出分水器中的下层液体后,继续加热,蒸出多余的乙醇和环己烷.
反应完成的标志是分水器中下层(水层)液面不再升高.
(3)步骤③碳酸钠的作用是中和苯甲酸和硫酸,碳酸钠固体需搅拌下分批加入的原因加入过快大量泡沫的产生可使液体溢出.
(4)步骤④将中和后的液体转入分液漏斗分出有机层,水层用25mL乙醚萃取,然后合并至有机层,用无水MgSO4干燥.乙醚的作用萃取出水层中溶解的苯甲酸乙酯,提高产率.
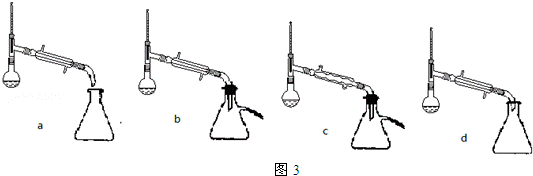
(5)步骤⑤蒸馏操作中,图3装置最好的是b d(填标号),蒸馏时先低温蒸出乙醚,蒸馏乙醚时最好采用水浴加热(水浴加热、直接加热、油浴加热).
(6)最终得到6.75g纯品,则苯甲酸乙酯的产率是90%.
制备苯甲酸乙酯的反应原理
 +C2H5OH$\stackrel{H_{2}SO_{4}}{?}$
+C2H5OH$\stackrel{H_{2}SO_{4}}{?}$ +H2O
+H2O相关物质的部分物理性质如表格:
| 沸点(℃) | 密度(g•cm-3) | |
| 苯甲酸 | 249 | 1.2659 |
| 苯甲酸乙酯 | 212.6 | 1.05 |
| 乙醇 | 78.5 | 0.7893 |
| 环已烷 | 80.8 | 0.7785 |
| 乙醚 | 34.51 | 0.7318 |
| 环已烷、乙醇和水共沸物 | 62.1 |

(1)制备苯甲酸乙酯,图2装置最合适的是B,反应液中的环己烷在本实验中的作用带出生成的水,促进酯化反应向正向进行.

(2)步骤②控制温度在65~70℃缓慢加热液体回流,分水器中逐渐出现上、下两层液体,直到反应完成,停止加热.放出分水器中的下层液体后,继续加热,蒸出多余的乙醇和环己烷.
反应完成的标志是分水器中下层(水层)液面不再升高.
(3)步骤③碳酸钠的作用是中和苯甲酸和硫酸,碳酸钠固体需搅拌下分批加入的原因加入过快大量泡沫的产生可使液体溢出.
(4)步骤④将中和后的液体转入分液漏斗分出有机层,水层用25mL乙醚萃取,然后合并至有机层,用无水MgSO4干燥.乙醚的作用萃取出水层中溶解的苯甲酸乙酯,提高产率.
(5)步骤⑤蒸馏操作中,图3装置最好的是b d(填标号),蒸馏时先低温蒸出乙醚,蒸馏乙醚时最好采用水浴加热(水浴加热、直接加热、油浴加热).

(6)最终得到6.75g纯品,则苯甲酸乙酯的产率是90%.
2.下列离子方程式的书写正确的是( )
| A. | 硫化钠水解:S2-+2H2O?H2S↑+2OH- | |
| B. | 硫氢化钠水解:HS-+H2O?H3O++S2- | |
| C. | 硫化钾水解:S2-+H2O?HS-+OH- | |
| D. | 硫酸铝溶液跟碳酸氢钠溶液反应:Al3++3HCO3-+6H2O?Al(OH)3↓+3CO2↑ |
19.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 含0.1mol•L -1CaCl2的溶液:SO42-、Na+、NO 3-、Cl- | |
| B. | 使酚酞变红色的溶液:NH 4+、K+、SO42-、NO 3- | |
| C. | 澄清透明溶液:Mg 2+、Na+、Cl-、SO4 2- | |
| D. | 在含有大量HCO 3-的溶液中:Na +、NO 3-、Cl-、OH- |
3.下列叙述中正确的是( )
| A. | 金属原子失电子越多,其还原性越强 | |
| B. | 制成0.5L 1mol/L的Na2CO3溶液,需要Na2CO3•10H2O晶体质量为143克 | |
| C. | 相同条件下,NA个氧气分子和NA个氮气分子的密度比等于7:8 | |
| D. | 配制480 mL溶液时,选择规格为480 mL的容量瓶 |
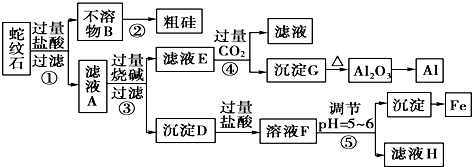
2.蛇纹石矿可以看做由MgO、Fe2O3、Al2O3和SiO2组成.某实验小组设计如下流程欲分别制得单质Mg、Fe、Al和Si.
有关氢氧化物沉淀时的pH见如表:
请回答下列问题:
(1)滤液A中含有的阳离子有Fe3+、Al3+、Mg2+、H+;
(2)操作④中生成沉淀G的离子方程式为AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;
(3)由G反应生成Al2O3的反应方程式2Al(OH)3$\frac{\underline{\;\;△\;\;}}{\;}$Al2O3+3H2O;
(4)操作⑤中调节pH=5~6时,可以用到的试剂为c(填字母).
a.NaOH溶液 b.氨水 c.MgO
(5)由滤液H制取金属Mg的流程如下:
滤液H$\stackrel{加热浓缩}{→}$$\stackrel{冷却结晶}{→}$MgCl2•6MgCl2-→Mg
该流程中由MgCl2冶炼Mg的方法是电解.

有关氢氧化物沉淀时的pH见如表:
| 金属阳离子 | 氢氧化物开始沉淀时的pH | 氢氧化物完全沉淀时的pH |
| Fe3+ | 1.9 | 3.2 |
| Mg2+ | 9.4 | 11.6 |
(1)滤液A中含有的阳离子有Fe3+、Al3+、Mg2+、H+;
(2)操作④中生成沉淀G的离子方程式为AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;
(3)由G反应生成Al2O3的反应方程式2Al(OH)3$\frac{\underline{\;\;△\;\;}}{\;}$Al2O3+3H2O;
(4)操作⑤中调节pH=5~6时,可以用到的试剂为c(填字母).
a.NaOH溶液 b.氨水 c.MgO
(5)由滤液H制取金属Mg的流程如下:
滤液H$\stackrel{加热浓缩}{→}$$\stackrel{冷却结晶}{→}$MgCl2•6MgCl2-→Mg
该流程中由MgCl2冶炼Mg的方法是电解.
 产物不稳定,受热即脱水而生成不饱和醛.
产物不稳定,受热即脱水而生成不饱和醛.
 ;F
;F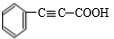 .
. +CH3CHO$\stackrel{△}{→}$
+CH3CHO$\stackrel{△}{→}$ +2NaOH$→_{△}^{乙醇}$
+2NaOH$→_{△}^{乙醇}$