题目内容
17.下列有关实验仪器的使用及实验操作正确的是( )| A. | 加热蒸发皿和烧杯必须垫石棉网 | |
| B. | 除去乙醇中的乙酸,加入NaOH溶液后分液 | |
| C. | 将硫酸铜溶液蒸发浓缩、冷却结晶得到CuSO4•5H2O | |
| D. | 配制1 L 0.1mol•L-1NaCl溶液的实验中,用托盘天平称取5.85g NaCl |
分析 A.蒸发皿可直接加热;
B.乙酸与NaOH反应后,与乙醇互溶,但沸点不同;
C.由溶液得到含结晶水的晶体,需要冷却结晶法;
D.托盘天平的感量为0.1g.
解答 解:A.蒸发皿可直接加热,而烧杯必须垫石棉网加热,故A错误;
B.乙酸与NaOH反应后,与乙醇互溶,但沸点不同,应选蒸馏法分离,故B错误;
C.硫酸铜溶液蒸发浓缩、冷却结晶得到CuSO4•5H2O,操作合理,故C正确;
D.托盘天平的感量为0.1g,则配制1 L 0.1mol•L-1NaCl溶液的实验中,用托盘天平称取5.8g或5.9g NaCl,故D错误;
故选C.
点评 本题考查化学实验方案的评价,为高频考点,把握仪器的使用、混合物分离提纯、溶液配制、实验技能为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.

练习册系列答案
相关题目
2.古丝绸之路贸易中的下列商品,主要成分属于无机物的是( )
| A. |  瓷器 | B. |  丝绸 | C. |  茶叶 茶叶 | D. |  中草药 中草药 |
17.用沉淀滴定法快速测定NaI等碘化物溶液中c(I-),实验过程包括准备标准溶液和滴定待测溶液.
Ⅰ准备标准溶液
a.准确称取AgNO3基准物4.2468g(0.0250mol)后,配制成250mL标准溶液,放在棕色试剂瓶中避光保存,备用.
b.配制并标定100mL 0.1000mol•L-1 NH4SCN标准溶液,备用.
Ⅱ滴定的主要步骤
a.取待测NaI溶液25.00mL于锥形瓶中.
b.加入25.00mL 0.1000mol•L-1 AgNO3溶液(过量),使I-完全转化为AgI沉淀.
c.加入NH4Fe(SO4)2溶液作指示剂.
d.用0.1000mol•L-1NH4SCN溶液滴定过量的Ag+,使其恰好完全转化为AgSCN沉淀后,体系出现淡红色,停止滴定.
e.重复上述操作两次.三次测定数据如下表:
f.数据处理.
回答下列问题:
(1)将称得的AgNO3配制成标准溶液,所使用的仪器除烧杯和玻璃棒外还有250mL(棕色)容量瓶、胶头滴管.
(2)AgNO3标准溶液放在棕色试剂瓶中避光保存的原因是避免AgNO3见光分解.
(3)滴定应在pH<0.5的条件下进行,其原因是防止因Fe3+的水解而影响滴定终点的判断(或抑制Fe3+的水解).
(4)b和c两步操作是否可以颠倒否(或不能),说明理由若颠倒,Fe3+与I-反应,指示剂耗尽,无法判断滴定终点.
(5)所消耗的NH4SCN标准溶液平均体积为10.00mL,测得c(I-)=0.0600mol•L-1.
(6)在滴定管中装入NH4SCN标准溶液的前一步,应进行的操作为用NH4SCN标准溶液进行润洗;.
(7)判断下列操作对c(I-)测定结果的影响(填“偏高”、“偏低”或“无影响”)
①若在配制AgNO3标准溶液时,烧杯中的溶液有少量溅出,则测定结果偏高.
②若在滴定终点读取滴定管刻度时,俯视标准液液面,则测定结果偏高.
Ⅰ准备标准溶液
a.准确称取AgNO3基准物4.2468g(0.0250mol)后,配制成250mL标准溶液,放在棕色试剂瓶中避光保存,备用.
b.配制并标定100mL 0.1000mol•L-1 NH4SCN标准溶液,备用.
Ⅱ滴定的主要步骤
a.取待测NaI溶液25.00mL于锥形瓶中.
b.加入25.00mL 0.1000mol•L-1 AgNO3溶液(过量),使I-完全转化为AgI沉淀.
c.加入NH4Fe(SO4)2溶液作指示剂.
d.用0.1000mol•L-1NH4SCN溶液滴定过量的Ag+,使其恰好完全转化为AgSCN沉淀后,体系出现淡红色,停止滴定.
e.重复上述操作两次.三次测定数据如下表:
| 实验序号 | 1 | 2 | 3 |
| 消耗NH4SCN标准溶液体积/mL | 10.24 | 10.02 | 9.98 |
回答下列问题:
(1)将称得的AgNO3配制成标准溶液,所使用的仪器除烧杯和玻璃棒外还有250mL(棕色)容量瓶、胶头滴管.
(2)AgNO3标准溶液放在棕色试剂瓶中避光保存的原因是避免AgNO3见光分解.
(3)滴定应在pH<0.5的条件下进行,其原因是防止因Fe3+的水解而影响滴定终点的判断(或抑制Fe3+的水解).
(4)b和c两步操作是否可以颠倒否(或不能),说明理由若颠倒,Fe3+与I-反应,指示剂耗尽,无法判断滴定终点.
(5)所消耗的NH4SCN标准溶液平均体积为10.00mL,测得c(I-)=0.0600mol•L-1.
(6)在滴定管中装入NH4SCN标准溶液的前一步,应进行的操作为用NH4SCN标准溶液进行润洗;.
(7)判断下列操作对c(I-)测定结果的影响(填“偏高”、“偏低”或“无影响”)
①若在配制AgNO3标准溶液时,烧杯中的溶液有少量溅出,则测定结果偏高.
②若在滴定终点读取滴定管刻度时,俯视标准液液面,则测定结果偏高.
5.一定条件下,在体积为V L的密闭容器中发生化学反应CO(g)+2H2(g)?CH3OH(g),可判断该可逆反应达到化学平衡状态的标志是( )
| A. | v生成(CH3OH)=v消耗(CO) | |
| B. | 混合气体的密度不再改变 | |
| C. | 混合气体的平均相对分子质量不再改变 | |
| D. | CO、H2、CH3OH的浓度比为1:2:1 |
12.下列实验操作能达到相应实验目的是( )
| 选项 | 实验操作 | 实验目的 |
| A | 将乙烯通入酸性KMnO4溶液中 | 证明乙烯能发生加成反应 |
| B | 向含酚酞的NaOH溶液中加入氯水 | 证明Cl2具有漂白性 |
| C | 常温下,向Fe和Cu中分别加入稀盐酸 | 比较Fe和Cu的金属活动性 |
| D | 将两根铁钉分别放入甲乙两支试管中,甲为干燥的试管,乙中含有少量食盐水. | 证明有NaCl参加反应,腐蚀速率更快 |
| A. | A | B. | B | C. | C | D. | D |
2.化学与生产、生活密切相关.下列说法正确的是( )
| A. | 氢氧燃料电池、硅太阳能电池都利用了原电池原理 | |
| B. | 苯是从煤和石油中加工制得的一种重要的化工原料 | |
| C. | 汽车尾气中含有的氮氧化物,是汽油不完全燃烧造成的 | |
| D. | 可用热的饱和Na2CO3溶液除去金属表面的矿物油 |
9.温度为T1时,在三个容积均为1L的恒容密闭容器中仅发生反应:2NO2(g)?2NO(g)+O2 (g) (正反应吸热).实验测得:v正=v (NO2 )消耗=k正c2(NO2 ),v逆=v(NO)消耗=2v (O2 )消耗=k逆c2 (NO)•c(O2 ),k正、k逆为速率常数,受温度影响.下列说法正确的是( )
| 容器编号 | 物质的起始浓度(mol•L-1) | 物质的平衡浓度(mol•L-1) | ||
| c(NO2) | c(NO) | c(O2) | c(O2) | |
| Ⅰ | 0.6 | 0 | 0 | 0.2 |
| Ⅱ | 0.3 | 0.5 | 0.2 | |
| Ⅲ | 0 | 0.5 | 0.35 | |
| A. | 达平衡时,容器Ⅰ与容器Ⅱ中的总压强之比为 4:5 | |
| B. | 达平衡时,容器Ⅱ中 c(O2 )/c(NO2 ) 比容器Ⅰ中的大 | |
| C. | 达平衡时,容器Ⅲ中 NO 的体积分数小于50% | |
| D. | 当温度改变为 T2时,若 k正=k逆,则 T2>T1 |
11.茶叶中铁元素的检验可经过以下四个步骤完成,各步骤中选用的实验用品使用不恰当的是( )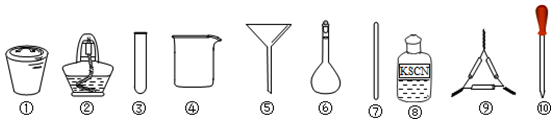

| A. | 将茶叶灼烧灰化,选用①、②、⑦和⑨ | |
| B. | 用浓硝酸溶解茶叶并加蒸馏水稀释,选用③和⑩ | |
| C. | 过滤得到滤液,选用④、⑤和⑦ | |
| D. | 检验中滤液中的Fe3+,选用③、⑧和⑩ |
12.W、X、Y、Z是原子序数依次增大的短周期主族元素,W的氢化物常用作制冷剂,W与Y最外层电子数之和与X最外层电子数相等,Z最外层电子数等于最内层电子数.下列说法正确的是( )
| A. | Y的最高价氧化物对应水化物的碱性比Z的弱 | |
| B. | W的气态氢化物比X的稳定 | |
| C. | 离子半径的大小顺序:r(W)>r(X)>r(Y)>r(Z) | |
| D. | Y3W与YW3中的化学键类型相同 |