题目内容
9.砷(As)是一些工厂和矿山废水中的污染元素,使用吸附剂是去除水中砷的有效措 施之一.(1)将硫酸锰、硝酸钇与氢氧化钠溶液按一定比例混合,搅拌使其充分反应,可获得一种砷的高效吸附剂X,吸附剂X中含有CO32-,其原因是碱性溶液吸收了空气中的CO2.
(2)H3AsO3和H3AsO4水溶液中含砷的各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系分别如图-1和图-2所示.

①以酚酞为指示剂(变色范围pH 8.0~10.0),将NaOH溶液逐滴加入到H3AsO3溶液中,当溶液由无色变为浅红色时停止滴加.该过程中主要反应的离子方程式为OH-+H3AsO3=H2AsO3-+H2O.
②H3AsO4第一步电离方程式H3AsO4?H2AsO4-+H+的电离常数为Ka1,则pKa1=2.2(p Ka1=-lg Ka1 ).
(3)溶液的pH对吸附剂X表面所带电荷有影响.pH=7.1时,吸附剂X表面不带电荷; pH>7.1时带负电荷,pH越高,表面所带负电荷越多;pH<7.1时带正电荷,pH越低,表面所带正电荷越多.pH不同时吸附剂X对三价砷和五价砷的平衡吸附量(吸附达平衡时单位质量吸附剂X吸附砷的质量)如图-3所示.
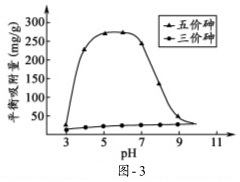
①在pH7~9之间,吸附剂X对五价砷的平衡吸附量随pH升高而迅速下降,其原因是在pH7~9之间,随pH升高H2AsO4-转变为HAsO42-,吸附剂X表面所带负电荷增多,静电斥力增加.
②在pH4~7之间,吸附剂X对水中三价砷的去除能力远比五价砷的弱,这是因为在pH4~7之间,吸附剂X表面带正电,五价砷主要以H2AsO4-和HAsO42-阴离子存在,静电引力较大;而三价砷主要以H3AsO3分子存在,与吸附剂X表面产生的静电引力小. 提高吸附剂X对三价砷去除效果可采取的措施是加入氧化剂,将三价砷转化为五价砷.
分析 (1)空气中的CO2属于酸性氧化物,能溶于强碱溶液;
(2)①根据图知,碱性条件下H3AsO3的浓度减小、H2AsO3-浓度增大,说明碱和H3AsO3生成H2AsO3-,该反应为酸碱的中和反应;
②Ka1=$\frac{c({H}_{2}As{{O}_{4}}^{-}).c({H}^{+})}{c({H}_{3}As{O}_{4})}$,pH=2.2时c(H+)=10-2.2 mol/L,c(H3AsO3)=c(H2AsO3-);
(3)①吸附剂X表面所带负电荷增多,静电斥力越大;
②在pH4~7之间,吸附剂X表面带正电,五价砷主要以H2AsO4-和HAsO42-阴离子存在,pH<7.1时带正电荷,pH越低,表面所带正电荷越多;而三价砷主要以H3AsO3分子存在;
在pH4~7之间,吸附剂X对水中三价砷的去除能力远比五价砷的弱,如果能将三价砷转化为五价砷,能有效的去除三价砷.
解答 解:(1)空气中的CO2属于酸性氧化物,能溶于强碱溶液,NaOH是碱,能吸收空气中的二氧化碳而生成碳酸根离子,所以其原因是碱性溶液吸收了空气中的CO2,故答案为:碱性溶液吸收了空气中的CO2;
(2)①根据图知,碱性条件下H3AsO3的浓度减小、H2AsO3-浓度增大,说明碱和H3AsO3生成H2AsO3-,该反应为酸碱的中和反应,同时还生成水,离子方程式为OH-+H3AsO3=H2AsO3-+H2O,
故答案为:OH-+H3AsO3=H2AsO3-+H2O;
②Ka1=$\frac{c({H}_{2}As{{O}_{4}}^{-}).c({H}^{+})}{c({H}_{3}As{O}_{4})}$,pH=2.2时c(H+)=10-2.2 mol/L,c(H3AsO3)=c(H2AsO3-),p Ka1=-lg Ka1=-lg$\frac{c({H}_{2}As{{O}_{4}}^{-}).c({H}^{+})}{c({H}_{3}As{O}_{4})}$=2.2,
故答案为:2.2;
(3)①吸附剂X表面所带负电荷增多,静电斥力越大,在pH7~9之间,随pH升高H2AsO4-转变为HAsO42-,吸附剂X表面所带负电荷增多,静电斥力增加,导致在pH7~9之间,吸附剂X对五价砷的平衡吸附量随pH升高而迅速下降,
故答案为:在pH7~9之间,随pH升高H2AsO4-转变为HAsO42-,吸附剂X表面所带负电荷增多,静电斥力增加;
②在pH4~7之间,吸附剂X表面带正电,五价砷主要以H2AsO4-和HAsO42-阴离子存在,pH<7.1时带正电荷,pH越低,表面所带正电荷越多,所以静电引力较大;而三价砷主要以H3AsO3分子存在,与吸附剂X表面产生的静电引力小,所以在pH4~7之间,吸附剂X对水中三价砷的去除能力远比五价砷的弱;
在pH4~7之间,吸附剂X对水中三价砷的去除能力远比五价砷的弱,如果能将三价砷转化为五价砷,能有效的去除三价砷,所以采取的措施是加入氧化剂,将三价砷转化为五价砷,
故答案为:在pH4~7之间,吸附剂X表面带正电,五价砷主要以H2AsO4-和HAsO42-阴离子存在,静电引力较大;而三价砷主要以H3AsO3分子存在,与吸附剂X表面产生的静电引力小;加入氧化剂,将三价砷转化为五价砷.
点评 本题以含有As的物质为载体考查弱电解质的电离及图象分析,为高频考点,侧重考查学生对基础知识的掌握和灵活运用、图象分析判断能力,明确出题人的目的是解本题关键,难点是图象的正确理解和分析,题目难度中等.

Ⅰ准备标准溶液
a.准确称取AgNO3基准物4.2468g(0.0250mol)后,配制成250mL标准溶液,放在棕色试剂瓶中避光保存,备用.
b.配制并标定100mL 0.1000mol•L-1 NH4SCN标准溶液,备用.
Ⅱ滴定的主要步骤
a.取待测NaI溶液25.00mL于锥形瓶中.
b.加入25.00mL 0.1000mol•L-1 AgNO3溶液(过量),使I-完全转化为AgI沉淀.
c.加入NH4Fe(SO4)2溶液作指示剂.
d.用0.1000mol•L-1NH4SCN溶液滴定过量的Ag+,使其恰好完全转化为AgSCN沉淀后,体系出现淡红色,停止滴定.
e.重复上述操作两次.三次测定数据如下表:
| 实验序号 | 1 | 2 | 3 |
| 消耗NH4SCN标准溶液体积/mL | 10.24 | 10.02 | 9.98 |
回答下列问题:
(1)将称得的AgNO3配制成标准溶液,所使用的仪器除烧杯和玻璃棒外还有250mL(棕色)容量瓶、胶头滴管.
(2)AgNO3标准溶液放在棕色试剂瓶中避光保存的原因是避免AgNO3见光分解.
(3)滴定应在pH<0.5的条件下进行,其原因是防止因Fe3+的水解而影响滴定终点的判断(或抑制Fe3+的水解).
(4)b和c两步操作是否可以颠倒否(或不能),说明理由若颠倒,Fe3+与I-反应,指示剂耗尽,无法判断滴定终点.
(5)所消耗的NH4SCN标准溶液平均体积为10.00mL,测得c(I-)=0.0600mol•L-1.
(6)在滴定管中装入NH4SCN标准溶液的前一步,应进行的操作为用NH4SCN标准溶液进行润洗;.
(7)判断下列操作对c(I-)测定结果的影响(填“偏高”、“偏低”或“无影响”)
①若在配制AgNO3标准溶液时,烧杯中的溶液有少量溅出,则测定结果偏高.
②若在滴定终点读取滴定管刻度时,俯视标准液液面,则测定结果偏高.
| A. | Fe$→_{点燃}^{Cl_{2}}$FeCl2$\stackrel{NaOH(ap)}{→}$Fe(OH)2 | |
| B. | S$→_{点燃}^{O_{2}}$SO3$\stackrel{H_{2}O}{→}$H2SO4 | |
| C. | CaCO3$\stackrel{高温}{→}$CaO$→_{高温}^{SiO_{2}}$CaSiO3 | |
| D. | NH3$→_{催化剂、△}^{O_{2}}$NO$\stackrel{H_{2}O}{→}$HNO3 |
| A. | v生成(CH3OH)=v消耗(CO) | |
| B. | 混合气体的密度不再改变 | |
| C. | 混合气体的平均相对分子质量不再改变 | |
| D. | CO、H2、CH3OH的浓度比为1:2:1 |
| 选项 | 实验操作 | 实验目的 |
| A | 将乙烯通入酸性KMnO4溶液中 | 证明乙烯能发生加成反应 |
| B | 向含酚酞的NaOH溶液中加入氯水 | 证明Cl2具有漂白性 |
| C | 常温下,向Fe和Cu中分别加入稀盐酸 | 比较Fe和Cu的金属活动性 |
| D | 将两根铁钉分别放入甲乙两支试管中,甲为干燥的试管,乙中含有少量食盐水. | 证明有NaCl参加反应,腐蚀速率更快 |
| A. | A | B. | B | C. | C | D. | D |
| 容器编号 | 物质的起始浓度(mol•L-1) | 物质的平衡浓度(mol•L-1) | ||
| c(NO2) | c(NO) | c(O2) | c(O2) | |
| Ⅰ | 0.6 | 0 | 0 | 0.2 |
| Ⅱ | 0.3 | 0.5 | 0.2 | |
| Ⅲ | 0 | 0.5 | 0.35 | |
| A. | 达平衡时,容器Ⅰ与容器Ⅱ中的总压强之比为 4:5 | |
| B. | 达平衡时,容器Ⅱ中 c(O2 )/c(NO2 ) 比容器Ⅰ中的大 | |
| C. | 达平衡时,容器Ⅲ中 NO 的体积分数小于50% | |
| D. | 当温度改变为 T2时,若 k正=k逆,则 T2>T1 |
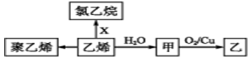
| A. | 甲与CH3OCH3互为同分异构体 | B. | X为Cl2 | ||
| C. | 聚乙烯是纯净物 | D. | 甲→乙反应类型为取代反应 |
 某实验小组设计如下流程,模拟将汽车尾气中的氮氧化物(主要为NO和NO2的混合物)转化为工业用盐亚硝酸钠(NaNO2),并对亚硝酸钠进行多角度探究:汽车尾气$→_{操作①}^{20%NaOH}$溶液$\stackrel{操作②}{→}$固体$→_{③}^{操作}$NaNO2
某实验小组设计如下流程,模拟将汽车尾气中的氮氧化物(主要为NO和NO2的混合物)转化为工业用盐亚硝酸钠(NaNO2),并对亚硝酸钠进行多角度探究:汽车尾气$→_{操作①}^{20%NaOH}$溶液$\stackrel{操作②}{→}$固体$→_{③}^{操作}$NaNO2

 .B→C的反应条件为加热(或煅烧),C→Al的制备方法称为电解法.
.B→C的反应条件为加热(或煅烧),C→Al的制备方法称为电解法.