题目内容
9.工业上从废铅酸电池的铅膏回收铅的过程中,可用碳酸盐溶液与铅膏(主要成分为PbSO4)发生反应:PbSO4(s)+CO32-(aq)?PbCO3(s)+SO42-(aq).Ksp (PbCO3)=1.5×10-13,Ksp (PbSO4)=1.8×10-8某课题组用PbSO4为原料模拟该过程,探究上述反应的实验条件及固体产物的成分.(1)计算上述反应的平衡常数:K=1.2×105.
(2)加入足量NaHCO3溶液也可实现该转化,写出离子方程式2HCO3-+PbSO4=SO42-+PbCO3+H2O+CO2↑
(3)查阅文献:上述反应还可能生成碱式碳酸铅[2PbCO3•Pb(OH)2],它和PbCO3受热都易分解成PbO.该课题组对固体产物(不考虑PbSO4)的成分提出如下假设,
假设一:全部为2PbCO3•Pb(OH)2;
假设二:全部为PbCO3;
假设三:2PbCO3•Pb(OH)2 和PbCO3的混合物
为验证假设一是否成立,课题组进行如下研究.
| 实验步骤 | 实验现象和结论 |
| 取一定量样品充分干燥,然后将样品加热分解,将产生的气体依次通过盛有无水硫酸铜的干燥管和盛有澄清石灰水的洗气瓶. | 无水硫酸铜变蓝色,澄清石灰水变浑浊 说明样品全部是2PbCO3•Pb(OH)2 |
②如果不同意,请提出改进意见将气体依次通过足量的浓硫酸和澄清石灰水,并分别测量增重的质量,通过计算确定H元素和C元素的物质的量之比.若n(C):n(H)=1:1,则为假设一,若n(c):n(H)>1:1,则为假设三.
分析 (1)PbSO4(s)+CO32-(aq)?PbCO3(s)+SO42-(aq).依据平衡常数概念写出计算式;
(2)HCO3-可电离出CO32-,与PbSO4反应生成PbCO3;
(3)将样品加热,无水硫酸铜变蓝色,澄清石灰水变浑浊,可说明生成水和二氧化碳,但不能说明样品全部是2PbCO3•Pb(OH)2,也可能为2PbCO3•Pb(OH)2 和PbCO3的混合物,如为2PbCO3•Pb(OH)2,则满足n(C):n(H)=1:1.
解答 解:(1)平衡常数K=$\frac{c(S{O}_{4}^{2-})}{c(C{O}_{3}^{2-})}$=$\frac{c(P{b}^{2+})c(S{{O}_{4}}^{2-})}{c(P{b}^{2+})c(C{{O}_{3}}^{2-})}$=$\frac{1.8×1{0}^{-8}}{1.5×1{0}^{-13}}$=1.2×105,故答案为:1.2×105;
(2)HCO3-可电离出CO32-,与PbSO4反应生成PbCO3,反应的离子方程式为2HCO3-+PbSO4=SO42-+PbCO3+H2O+CO2↑,故答案为:2HCO3-+PbSO4=SO42-+PbCO3+H2O+CO2↑;
(3)①将样品加热,无水硫酸铜变蓝色,澄清石灰水变浑浊,可说明生成水和二氧化碳,但不能说明样品全部是2PbCO3•Pb(OH)2,也可能为2PbCO3•Pb(OH)2 和PbCO3的混合物,因2PbCO3•Pb(OH)2 和PbCO3的混合物分别也可使无水硫酸铜变蓝色,澄清石灰水变浑浊,
故答案为:不同意.若为假设三,有同样的现象;
②如为2PbCO3•Pb(OH)2,则满足n(C):n(H)=1:1,可将气体依次通过足量的浓硫酸和澄清石灰水,并分别测量增重的质量,通过计算确定H元素和C元素的物质的量之比.若n(C):n(H)=1:1,则为假设一,若n(c):n(H)>1:1,则为假设三,
故答案为:将气体依次通过足量的浓硫酸和澄清石灰水,并分别测量增重的质量,通过计算确定H元素和C元素的物质的量之比.若n(C):n(H)=1:1,则为假设一,若n(c):n(H)>1:1,则为假设三.
点评 本题以沉淀溶解平衡为切入点考查了平衡移动原理以及分析图象和数据处理能力,侧重于学生的分析、计算能力的考查,注意把握实验设计方案的思路和实验步骤,难度较大.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案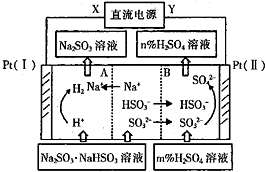
| A. | Pt(Ⅱ)为阳极 | B. | 阳极区[H+]增大 | ||
| C. | 图中的n<m | D. | 阴极电极反应式为2H++2e-═H2↑ |
①NaCl溶液 ②干冰(固态的二氧化碳) ③冰醋酸(纯净的醋酸) ④铜 ⑤BaSO4固体 ⑥蔗糖 ⑦酒精⑧熔融的KNO3.
| A. | ①③⑤⑧ | B. | ②③④⑤⑥⑦ | C. | ③⑤⑧ | D. | ①②③④⑤⑥⑦⑧ |
| A. | 同温同压下,相同体积的物质,其物质的量一定相等 | |
| B. | 任何条件下,等物质的量的甲烷和一氧化碳所含的分子数一定相等 | |
| C. | 1L一氧化碳气体一定比1L氧气的质量小 | |
| D. | 相同条件下的一氧化碳气体和氨气,若体积相等,则原子数一定相等 |
| A. | 若有9.8gH2SO4参加反应,则转移电子的物质的量为1mol | |
| B. | 该反应的化学方程式为:5PbO2+2MnSO4+2H2SO4═Pb(MnO4)2+4PbSO4+2H2O | |
| C. | Pb(MnO4)2既是氧化产物又是还原产物 | |
| D. | X是MnSO4 |

 铜合金是人类使用最早的金属材料.铜在化合物中的常见化合价有+l、+2 等,故能形成多种铜的化合物.
铜合金是人类使用最早的金属材料.铜在化合物中的常见化合价有+l、+2 等,故能形成多种铜的化合物. 