题目内容
14. 铜合金是人类使用最早的金属材料.铜在化合物中的常见化合价有+l、+2 等,故能形成多种铜的化合物.
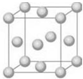
铜合金是人类使用最早的金属材料.铜在化合物中的常见化合价有+l、+2 等,故能形成多种铜的化合物. (l)基态 Cu 原子的电子排布式是1s22s22p63s23p63d104s1或[Ar]3d104s1;铜晶体晶胞如图所示,该晶胞实际拥有4个铜原子;
(2)某+l 价铜的配离子为[Cu(CN)4]3-,与配体(CN-)互为等电子体的一种微粒是CO、N2、C22- (写化学式).
(3)在硫酸铜溶液中逐滴滴加氨水至过量,先出现蓝色沉淀,最后溶解形成深蓝色的溶液.写出此蓝色沉淀溶解的离子方程式:Cu(OH)2+4NH3═[Cu(NH3)4]2++2OH-或Cu(OH)2+4NH3•H2O═[Cu(NH3)4]2++2OH-+4H2O;根据价层电子对互斥模型,预测SO42一的空间构型为正四面体.
分析 (1)铜是29号元素,原子核外有29个电子,根据构造原理书写其基态核外电子排布式;利用均摊法计算原子个数;
(2)原子个数相同、价电子数相同的微粒是等电子体;
(3)氢氧化铜和氨水反应生成铜氨络合离子和氢氧根离子,根据价层电子对互斥理论确定其空间构型.
解答 解:(1)铜是29号元素,原子核外有29个电子,根据构造原理知其核外电子排布式为:1s22s22p63s22p63d104s1,价电子排布为:3d104s1或[Ar]3d104s1,该晶胞中铜原子个数=8×$\frac{1}{8}$,故答案为:1s22s22p63s23p63d104s1 或[Ar]3d104s1;4;
(2)某+1价铜的配离子为[Cu(CN)4]3-,其配体是CN-,与配体为等电子体的微粒有:CO、N2、C22-等,
故答案为:CO、N2、C22-;
(3)氢氧化铜和氨水反应生成铜氨络合离子和氢氧根离子,离子反应方程式为:Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-或 Cu(OH)2+4NH3•H2O═[Cu(NH3)4]2++2OH-+4H2O,SO42-中S原子价层电子对=4+$\frac{1}{2}$(6+2-4×2)=4,且不含孤电子对,所以是正四面体结构,
故答案为:Cu(OH)2+4NH3═[Cu(NH3)4]2++2OH-或 Cu(OH)2+4NH3•H2O═[Cu(NH3)4]2++2OH-+4H2O;正四面体.
点评 本题考查物质结构,较综合,侧重于学生的分析能力的考查,题目涉及知识都是学习重点,会利用价层电子对互斥理论确定杂化方式、微粒空间构型,难度中等.

练习册系列答案
相关题目
9.工业上从废铅酸电池的铅膏回收铅的过程中,可用碳酸盐溶液与铅膏(主要成分为PbSO4)发生反应:PbSO4(s)+CO32-(aq)?PbCO3(s)+SO42-(aq).Ksp (PbCO3)=1.5×10-13,Ksp (PbSO4)=1.8×10-8某课题组用PbSO4为原料模拟该过程,探究上述反应的实验条件及固体产物的成分.
(1)计算上述反应的平衡常数:K=1.2×105.
(2)加入足量NaHCO3溶液也可实现该转化,写出离子方程式2HCO3-+PbSO4=SO42-+PbCO3+H2O+CO2↑
(3)查阅文献:上述反应还可能生成碱式碳酸铅[2PbCO3•Pb(OH)2],它和PbCO3受热都易分解成PbO.该课题组对固体产物(不考虑PbSO4)的成分提出如下假设,
假设一:全部为2PbCO3•Pb(OH)2;
假设二:全部为PbCO3;
假设三:2PbCO3•Pb(OH)2 和PbCO3的混合物
为验证假设一是否成立,课题组进行如下研究.
①你是否同意该同学的结论,并简述理由不同意.若为假设三,有同样的现象.
②如果不同意,请提出改进意见将气体依次通过足量的浓硫酸和澄清石灰水,并分别测量增重的质量,通过计算确定H元素和C元素的物质的量之比.若n(C):n(H)=1:1,则为假设一,若n(c):n(H)>1:1,则为假设三.
(1)计算上述反应的平衡常数:K=1.2×105.
(2)加入足量NaHCO3溶液也可实现该转化,写出离子方程式2HCO3-+PbSO4=SO42-+PbCO3+H2O+CO2↑
(3)查阅文献:上述反应还可能生成碱式碳酸铅[2PbCO3•Pb(OH)2],它和PbCO3受热都易分解成PbO.该课题组对固体产物(不考虑PbSO4)的成分提出如下假设,
假设一:全部为2PbCO3•Pb(OH)2;
假设二:全部为PbCO3;
假设三:2PbCO3•Pb(OH)2 和PbCO3的混合物
为验证假设一是否成立,课题组进行如下研究.
| 实验步骤 | 实验现象和结论 |
| 取一定量样品充分干燥,然后将样品加热分解,将产生的气体依次通过盛有无水硫酸铜的干燥管和盛有澄清石灰水的洗气瓶. | 无水硫酸铜变蓝色,澄清石灰水变浑浊 说明样品全部是2PbCO3•Pb(OH)2 |
②如果不同意,请提出改进意见将气体依次通过足量的浓硫酸和澄清石灰水,并分别测量增重的质量,通过计算确定H元素和C元素的物质的量之比.若n(C):n(H)=1:1,则为假设一,若n(c):n(H)>1:1,则为假设三.
19.下列关于胶体的叙述错误的是( )
| A. | 胶体区别于其它分散系的本质特征是分散质的微粒直径在1nm~100nm之间 | |
| B. | 用平行光照射CuSO4溶液和Fe(OH)3胶体,可以加以区分 | |
| C. | 把FeCl3饱和溶液滴入到NaOH溶液中,以制取Fe(OH)3胶体 | |
| D. | 胶体是一种介稳性的分散系,其粒子能通过滤纸 |
6.某溶液中含有大量的下列离子:Mg2+、NO3-、K+和M离子,经测定Mg2+、NO3-、K+离子的物质的量浓度之比为2:4:1,则M离子可能是下列中的( )
| A. | H+ | B. | SO42- | C. | OH- | D. | Na+ |
4.将下列四种铁的化合物溶于稀盐酸,滴加KSCN溶液没有颜色变化,再加入氯水即呈红色的是( )
| A. | FeO | B. | Fe2O3 | C. | FeCl3 | D. | Fe3O4 |

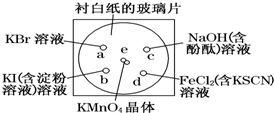 化学实验的微型化可有效地减少污染,实现化学实验绿色化的要求.某学生按下列操作做一个实验:在一块下衬白纸的玻璃片的不同位置分别滴加浓度为0.1mol/L的KBr、KI(含淀粉溶液)、NaOH(含酚酞)、FeCl2(含KSCN)溶液各1滴,每种液滴彼此分开,围成半径小于表面皿的圆形(如下图所示),在圆心处放置2粒芝麻粒大小的KMnO4晶体,向KMnO4晶体滴加一滴浓盐酸,再立即将表面皿盖好.(已知:2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O
化学实验的微型化可有效地减少污染,实现化学实验绿色化的要求.某学生按下列操作做一个实验:在一块下衬白纸的玻璃片的不同位置分别滴加浓度为0.1mol/L的KBr、KI(含淀粉溶液)、NaOH(含酚酞)、FeCl2(含KSCN)溶液各1滴,每种液滴彼此分开,围成半径小于表面皿的圆形(如下图所示),在圆心处放置2粒芝麻粒大小的KMnO4晶体,向KMnO4晶体滴加一滴浓盐酸,再立即将表面皿盖好.(已知:2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O