题目内容
10. 某酸性工业废水中含有K2Cr2O7.光照下,草酸(H2C2O4)能将其中的Cr2O72-转化为Cr2+.某课题组研究发现,少量铁明矾[Al2Fe(SO4)4•4H2O]即可对该反应起催化作用,为进一步研究有关因素对该反应速率的影响,探究如下:
某酸性工业废水中含有K2Cr2O7.光照下,草酸(H2C2O4)能将其中的Cr2O72-转化为Cr2+.某课题组研究发现,少量铁明矾[Al2Fe(SO4)4•4H2O]即可对该反应起催化作用,为进一步研究有关因素对该反应速率的影响,探究如下:(1)在25℃下,控制光照强度、废水样品初始浓度和催化剂用量相同,调节不同的初始pH和一定浓度草酸溶液用量,作对比实验,完成以下实验设计表(表中不要留空格).
| 实验编号 | 初始pH | 废水样品体积/mL | 草酸溶液体积/mL | 蒸馏水体积/mL |
| ① | 4 | a=60 | 10 | 30 |
| ② | 5 | 60 | 10 | c=30 |
| ③ | 5 | 60 | b=20 | 20 |
(2)上述反应后草酸被氧化为CO2(填化学式);
(3)实验①和②的结果表明,其他条件不变时,溶液的pH越小,反应速率越快;
(4)该课题组对铁明矾[Al2Fe(SO4)4•4H2O]中起催化作用的成分提出如下假设,请你完成假设三:
假设一:Fe2+起催化作用;
假设二:Al3+起催化作用
假设三:SO42-起催化作用.
(5)请你设计实验验证上述假设一,完成下表中内容.(除了上述实验提供的试剂外,可供选择的药品有K2SO4、FeSO4、K2SO4•Al2(SO4)3•24H2O、Al2(SO4)3等.(溶液中Cr2O72-的浓度可用仪器测定)
| 实验方案(不要求写具体操作过程) | 预期实验结果和结论 |
| 取等物质的量的K2SO4•Al2(SO4)3•24H2O代替实验①中的铁明矾,控制其他反条件与实验①相同,进行对比实验. | 反应进行相同时间后, 若溶液中的Cr2O72-浓度大于 实验①中的Cr2O72的浓度,则假设一成立; 若溶液中的Cr2O72-浓度等于 实验①中的Cr2O72的浓度,则假设一不成立. |
| 组数 | 1 | 2 | 3 | 4 |
| 消耗V(KMnO4)/ml | 20.04 | 20.00 | 18.90 | 19.96 |
分析 (1)根据实验目的“调节不同的初始pH和一定浓度草酸溶液用量,作对比实验”设置对比试验;
(2)根据氧化还原反应的原理,草酸还原性较强,遇到强氧化剂时被氧化成二氧化碳;
(3)实验①②表明溶液pH越小,反应的速率越快;
(4)根据铁明矾Al2Fe(SO4)4•4H2O的组成离子进行分析;
(5)证明亚铁离子是否具有催化作用,需要选择不含亚铁离子且含有铝离子和硫酸根离子的试剂进行对比实验,根据溶液中的Cr2O72-浓度与实验①中Cr2O72-浓度进行比较得出正确结论;
(6)计算体积的平均值,根据反应的离子方程式计算,滴定后俯视读数,会导致体积偏小.
解答 解:(1)①②中pH不同,是探究pH对速率的影响;做对比试验时,除了探究的量不同外,其它条件必须完全相同,所以①中废水条件为60mL、②中蒸馏水体积为30mL;试验中总体积必须相等,所以③中醋酸体积为20mL,其pH为5,以便通过②、③探究草酸浓度对反应速率的影响,
故答案为:
| 实验 编号 | 初始 pH | 废水样品 体积/mL | 草酸溶液 体积/mL | 蒸馏水 体积/mL |
| ① | 60 | |||
| ② | 30 | |||
| ③ | 20 |
故答案为:CO2;
(3)由实验①②表明溶液pH越小,反应的速率越快,所以溶液pH对该反应的速率有影响,
故答案为:溶液的pH越小,反应速率越快;
(4)根据铁明矾[Al2Fe(SO4)4•24H2O]组成分析,SO42-起催化作用,
故答案为:SO42-起催化作用;
(5)要证明Fe2+起催化作用,需做对比实验,再做没有Fe2+存在时的实验,所以要选K2SO4•Al2(SO4)3•24H2O;用等物质的量K2SO4•Al2(SO4)3•24H2O代替实验①中的铁明矾,控制其他反应条件与实验①相同,进行对比实验,反应进行相同时间后,若溶液中c(Cr2O72-)大于实验①中c(Cr2O72-),则假设一成立;若两溶液中的c(Cr2O72-)相同,则假设一不成立,
故答案为:等物质的量K2SO4•Al2(SO4)3•24H2O;大于;等于;
(6)取所配溶液25.00ml于锥形瓶中,加稀H2SO4酸化,用0.010mol/L KMnO4溶液滴定,第3组数据误差过大,舍去,所用高锰酸钾溶液体积为$\frac{20.04+20.00+19.96}{3}$mL=20.00mL,
n(MnO4-)=0.020L×0.01mol/L=2.0×10-4mol,
则n(Fe2+)=5×1.0×10-4mol=1.0×10-3mol,
5.6g晶体含有n(Fe2+)=5.0×10-3mol,
m(Fe2+)=56g/mol×5.00×10-3mol=0.28g,
实验测得该晶体中铁的质量分数为$\frac{0.28}{5.6}$×100%≈5.00%,滴定后俯视读数,会导致体积偏小,浓度偏小.
故答案为:11.20%;偏小.
点评 本题考查了探究影响反应速率因素及重铬酸根与草酸反应过程中的催化作用,涉及到相关的计算,题目难度中上,注意掌握探究影响化学反应速率因素的方法,试题培养了学生从图象中获取数据并分析的能力、设计实验的能力.

练习册系列答案
 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案
相关题目
19.少量铁粉与100mL 0.01mol•L-1的稀盐酸反应,反应速率太慢.为了加快此反应速率而不改变H2的产量,可以使用如下方法的( )
①加H2O
②滴入几滴浓HNO3
③滴入几滴浓盐酸
④加CH3COONa固体
⑤加NaCl固体
⑥升高温度(不考虑盐酸挥发)
⑦改用10mL 0.1mol•L-1盐酸.
①加H2O
②滴入几滴浓HNO3
③滴入几滴浓盐酸
④加CH3COONa固体
⑤加NaCl固体
⑥升高温度(不考虑盐酸挥发)
⑦改用10mL 0.1mol•L-1盐酸.
| A. | ②⑥⑦ | B. | ③⑤⑦ | C. | ③⑥⑦ | D. | ②③⑦ |
20.已知A(g)?B(g)+C(g)△H>0.当反应达到平衡时,下列措施:①升温,②恒容通人惰性气体,③增加B的浓度,④减压,⑤加催化剂,⑥恒压通人惰性气体,能提高A分解率的是( )
| A. | ①②④ | B. | ①④⑥ | C. | ②③⑥ | D. | ③⑤⑥ |
17.土卫六“泰坦”拥有丰富的碳氢燃料资源.“泰坦”的碳氢化合物循环在一定程度上与地球的水循环类似,以甲烷雨和碳氢雾的形式出现,或者以液态甲烷和乙烷湖的形式存在于地表,下列有关说法正确的是( )
| A. | 碳氢化合物就是烃 | |
| B. | 水、甲烷和乙烷都是10个电子的分子 | |
| C. | 乙烷的沸点比甲烷高,因而更难液化 | |
| D. | 甲烷和乙烷分子中只有一种氢,故其二氯化物也只有一种 |
5. 某学生用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液.
某学生用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液.
其操作可分解为如下几步:
a.移取20.00mL待测的NaOH溶液注入洁净的锥形瓶,并加入2-3滴酚酞
b.用标准盐酸溶液润洗滴定管2-3次
c.把盛有标准溶液的酸式滴定管固定好,调节液面使滴定管尖嘴充满溶液
d.取标准盐酸溶液注入酸式滴定管至0刻度以上2-3cm
e.调节液面至0或0刻度以下,记下读数
f.把锥形瓶放在滴定管的下面,用标准盐酸溶液滴定至终点,记下滴定管液面的刻度
完成以下填空:
(1)正确操作的顺序是(用序号字母填写)bdceaf.
(2)滴定终点时溶液的颜色变化是浅红色变为无色,且半分钟内不恢复.
(3)下列操作中可能使所测NaOH溶液的浓度数值偏低的是D.
A.酸式滴定管未用标准盐酸润洗就直接注入标准盐酸
B.滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
(4)若某次滴定开始和结束时,酸式滴定管中的液面如图所示,则反应消耗盐酸的体积为20.00 mL.
(5)某学生根据3次实验分别记录有关数据如下表:
依据上表数据求得NaOH溶液的物质的量浓度为0.0800mol/L(保留4位有效数字).
 某学生用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液.
某学生用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液.其操作可分解为如下几步:
a.移取20.00mL待测的NaOH溶液注入洁净的锥形瓶,并加入2-3滴酚酞
b.用标准盐酸溶液润洗滴定管2-3次
c.把盛有标准溶液的酸式滴定管固定好,调节液面使滴定管尖嘴充满溶液
d.取标准盐酸溶液注入酸式滴定管至0刻度以上2-3cm
e.调节液面至0或0刻度以下,记下读数
f.把锥形瓶放在滴定管的下面,用标准盐酸溶液滴定至终点,记下滴定管液面的刻度
完成以下填空:
(1)正确操作的顺序是(用序号字母填写)bdceaf.
(2)滴定终点时溶液的颜色变化是浅红色变为无色,且半分钟内不恢复.
(3)下列操作中可能使所测NaOH溶液的浓度数值偏低的是D.
A.酸式滴定管未用标准盐酸润洗就直接注入标准盐酸
B.滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
(4)若某次滴定开始和结束时,酸式滴定管中的液面如图所示,则反应消耗盐酸的体积为20.00 mL.
(5)某学生根据3次实验分别记录有关数据如下表:
| 滴定次数 | 待测NaOH溶液的体积/mL | 0.1000mol/L盐酸的体积/mL | ||
| 滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
| 第一次 | 25.00 | 0.20 | 20.22 | |
| 第二次 | 25.00 | 0.56 | 24.54 | |
| 第三次 | 25.00 | 0.42 | 20.40 | |
2.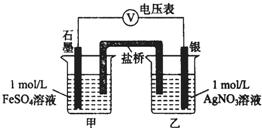 为探究Ag+与Fe3+氧化性的相关问题,某小组同学进行如下实验:
为探究Ag+与Fe3+氧化性的相关问题,某小组同学进行如下实验:
已知:相关物质的Ksp(20度) AgCl:1.8×10-10 Ag2SO4:1.4×10-5
(1)甲同学的实验如下:
注:经检验黑色固体为Ag.
①白色沉淀的化学式是Ag2SO4.
②甲同学得出Ag+氧化了Fe2+的依据是有黑色固体(Ag)生成,加入KSCN溶液后变红.
(2)乙同学为探究Ag+和Fe2+反应的程度,进行实验Ⅱ.
a.按如图连接装置并加入药品(盐桥中的物质不参与反应),发现电压表指针偏移.偏移的方向表明:电子由石墨经导线流向银.放置一段时间后,指针偏移减小.
b.随后向甲烧杯中逐渐加入浓Fe2(SO4)3溶液,发现电压表指针的变化依次为:偏移减小→回到零点→逆向偏移.
①a中甲烧杯里的电极反应式是Fe2+-e-=Fe3+.
②b中电压表指针逆向偏移后,银为负极(填“正”或“负”).
③由实验得出Ag+和Fe2+反应的离子方程式是Fe2++Ag+?Fe3++Ag.
(3)为进一步验证乙同学的结论,丙同学又进行了如下实验:
①实验Ⅲ不能(填“能”或“不能”)证明Fe3+氧化了Ag,理由是因为Fe(NO3)3溶液呈酸性,酸性条件下NO3-也可能氧化Ag.
②用化学反应原理解释实验Ⅳ与V的现象有所不同的原因溶液中存在平衡:Fe3++Ag?Fe2++Ag+,且 AgCl比Ag2SO4 Ksp(或溶解度)更小,Cl-比SO42-更有利于降低Ag+浓度,所以实验Ⅴ比实验Ⅳ正向进行的程度更大.(或AgCl比Ag2SO4 Ksp(或溶解度)更小,促使平衡正向移动,银镜溶解).
 为探究Ag+与Fe3+氧化性的相关问题,某小组同学进行如下实验:
为探究Ag+与Fe3+氧化性的相关问题,某小组同学进行如下实验:已知:相关物质的Ksp(20度) AgCl:1.8×10-10 Ag2SO4:1.4×10-5
(1)甲同学的实验如下:
| 序号 | 操作 | 现象 |
| 实验Ⅰ | 将2mL1mol/L AgNO3溶液加入到 1mL1mol/L FeSO4溶液中 | 产生白色沉淀,随后有黑色固体产生 |
| 取上层清液,滴加KSCN溶液 | 溶液变红 |
①白色沉淀的化学式是Ag2SO4.
②甲同学得出Ag+氧化了Fe2+的依据是有黑色固体(Ag)生成,加入KSCN溶液后变红.
(2)乙同学为探究Ag+和Fe2+反应的程度,进行实验Ⅱ.
a.按如图连接装置并加入药品(盐桥中的物质不参与反应),发现电压表指针偏移.偏移的方向表明:电子由石墨经导线流向银.放置一段时间后,指针偏移减小.
b.随后向甲烧杯中逐渐加入浓Fe2(SO4)3溶液,发现电压表指针的变化依次为:偏移减小→回到零点→逆向偏移.
①a中甲烧杯里的电极反应式是Fe2+-e-=Fe3+.
②b中电压表指针逆向偏移后,银为负极(填“正”或“负”).
③由实验得出Ag+和Fe2+反应的离子方程式是Fe2++Ag+?Fe3++Ag.
(3)为进一步验证乙同学的结论,丙同学又进行了如下实验:
| 序号 | 操作 | 现象 |
| 实验Ⅲ | 将2mL2mol/LFe(NO3)3溶液加入有银镜的试管中 | 银镜消失 |
| 实验Ⅳ | 将2mL1mol/LFe2(SO4)3溶液加入有银镜的试管中 | 银镜减少,未消失 |
| 实验Ⅴ | 将2mL2mol/LFeCl3溶液加入有银镜的试管中 | 银镜消失 |
②用化学反应原理解释实验Ⅳ与V的现象有所不同的原因溶液中存在平衡:Fe3++Ag?Fe2++Ag+,且 AgCl比Ag2SO4 Ksp(或溶解度)更小,Cl-比SO42-更有利于降低Ag+浓度,所以实验Ⅴ比实验Ⅳ正向进行的程度更大.(或AgCl比Ag2SO4 Ksp(或溶解度)更小,促使平衡正向移动,银镜溶解).
20.下列图示关系中,错误的是( )
| A. |  | B. |  | ||
| C. |  | D. |  |
 .
.