题目内容
15.某混合物A含有Al2(SO4)3、Al2O3和FeO,在一定条件下可实现如图所示的物质之间的变化: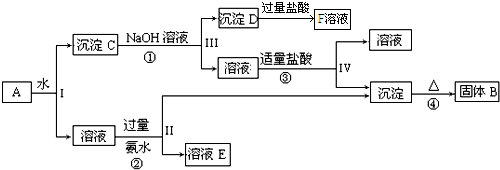
据此回答下列问题:
(1)I、Ⅱ、Ⅲ、Ⅳ四步中对于溶液和沉淀的分离采取的方法是过滤.
(2)写出反应①、②、③、④四个反应的方程式(是离子反应的写离子方程式)
①Al2O3+2OH-=2AlO2-+H2O;②Al3++3NH3.H2O=3NH4++Al(OH)3↓;③AlO2-+H2O+H+=Al(OH)3↓;④2Al(OH)3$\frac{\underline{\;\;△\;\;}}{\;}$Al2O3+3H2O.
(3)如果把步骤③中适量的盐酸改为过量的二氧化碳,则反应的离子方程式AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-.
(4)在空气中将NaOH溶液滴入F溶液中,观察到的现象是先生成白色沉淀,然后迅速变为灰绿色,最终变为红褐色,写出最终反应的化学方程式为4Fe(OH)2+O2+2H2O=4Fe(OH)3.
分析 Al2(SO4)3溶于水,Al2O3和FeO均不溶于水,混合物A加水溶解后,溶液中是Al2(SO4)3,沉淀C为Al2O3和FeO;由转化关系图可知,向沉淀C中加NaOH溶液,FeO不反应,沉淀D为FeO,Al2O3可与NaOH溶液反应生成NaAlO2,向NaAlO2溶液中通入CO2可得Al(OH)3沉淀,Al(OH)3受热分解生成固体B为Al2O3;向溶液中加过量氨水,溶液与过量氨水反应,Al3+被沉淀,得到氢氧化铝沉淀,溶液中E为(NH4)2SO4,经过蒸发、结晶,得到(NH4)2SO4,然后结合物质的性质及化学用语来解答.
解答 解:Al2(SO4)3溶于水,FeO和Fe2O3均不溶于水,混合物A加水溶解后,溶液中是Al2(SO4)3,沉淀C为Al2O3和FeO;
由转化关系图可知,向沉淀C中加NaOH溶液,FeO不反应,沉淀D为FeO,Al2O3可与NaOH溶液反应生成NaAlO2,向NaAlO2溶液中通入CO2可得Al(OH)3沉淀,Al(OH)3受热分解生成固体B为Al2O3;
向溶液中加过量氨水,溶液与过量氨水反应,Al3+被沉淀,得到氢氧化铝沉淀,溶液中E为(NH4)2SO4,经过蒸发、结晶,得到(NH4)2SO4,
(1)溶液和沉淀的分离利用过滤,故答案为:过滤;
(2)反应①为Al2O3+2OH-=2AlO2-+H2O,
反应②为Al3++3NH3.H2O=3NH4++Al(OH)3↓,
反应③为AlO2-+H2O+H+=Al(OH)3↓,
反应④为2Al(OH)3$\frac{\underline{\;\;△\;\;}}{\;}$Al2O3+3H2O,
故答案为:Al2O3+2OH-=2AlO2-+H2O;Al3++3NH3.H2O=3NH4++Al(OH)3↓,AlO2-+H2O+H+=Al(OH)3↓;2Al(OH)3$\frac{\underline{\;\;△\;\;}}{\;}$Al2O3+3H2O;
(3)向NaAlO2溶液中通入CO2可得Al(OH)3沉淀,即AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,故答案为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;
(4)氧化亚铁与盐酸反应生成氯化亚铁,氯化亚铁与氢氧化钠反应生成白色的氢氧化铁,迅速被氧化成灰绿色,最终变为红褐色,反应的方程式为:4Fe(OH)2+O2+2H2O=4Fe(OH)3;故答案为:先生成白色沉淀,然后迅速变为灰绿色,最终变为红褐色;4Fe(OH)2+O2+2H2O=4Fe(OH)3.
点评 本题考查无机物的推断,为高频考点,综合考查元素化合物性质,侧重Al、Fe及其化合物性质的考查,注意氧化铝的两性,明确发生的化学反应为解答的关键,题目难度中等.

 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案①不和碘或水起化学反应 ②能溶于水 ③不溶于水 ④应是极性溶剂 ⑤应是非极性溶剂.
| A. | ①②⑤ | B. | ②③④ | C. | ①③⑤ | D. | ①③④ |
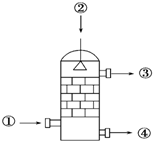 在硫酸工业生产中,SO3的吸收过程是在吸收塔(如图)中进行的,吸收塔里还装入了大量瓷环.下列说法中不正确的是( )
在硫酸工业生产中,SO3的吸收过程是在吸收塔(如图)中进行的,吸收塔里还装入了大量瓷环.下列说法中不正确的是( )| A. | 从①处通入SO3,整个吸收操作采取逆流的形式 | |
| B. | 从②处喷下98.3%的硫酸,瓷环的作用是增大接触面积 | |
| C. | 从③处导出的气体只含有少量SO2,可直接排入大气 | |
| D. | 从④处流出的是可用水或稀硫酸稀释的浓硫酸 |
 某酸性工业废水中含有K2Cr2O7.光照下,草酸(H2C2O4)能将其中的Cr2O72-转化为Cr2+.某课题组研究发现,少量铁明矾[Al2Fe(SO4)4•4H2O]即可对该反应起催化作用,为进一步研究有关因素对该反应速率的影响,探究如下:
某酸性工业废水中含有K2Cr2O7.光照下,草酸(H2C2O4)能将其中的Cr2O72-转化为Cr2+.某课题组研究发现,少量铁明矾[Al2Fe(SO4)4•4H2O]即可对该反应起催化作用,为进一步研究有关因素对该反应速率的影响,探究如下:(1)在25℃下,控制光照强度、废水样品初始浓度和催化剂用量相同,调节不同的初始pH和一定浓度草酸溶液用量,作对比实验,完成以下实验设计表(表中不要留空格).
| 实验编号 | 初始pH | 废水样品体积/mL | 草酸溶液体积/mL | 蒸馏水体积/mL |
| ① | 4 | a=60 | 10 | 30 |
| ② | 5 | 60 | 10 | c=30 |
| ③ | 5 | 60 | b=20 | 20 |
(2)上述反应后草酸被氧化为CO2(填化学式);
(3)实验①和②的结果表明,其他条件不变时,溶液的pH越小,反应速率越快;
(4)该课题组对铁明矾[Al2Fe(SO4)4•4H2O]中起催化作用的成分提出如下假设,请你完成假设三:
假设一:Fe2+起催化作用;
假设二:Al3+起催化作用
假设三:SO42-起催化作用.
(5)请你设计实验验证上述假设一,完成下表中内容.(除了上述实验提供的试剂外,可供选择的药品有K2SO4、FeSO4、K2SO4•Al2(SO4)3•24H2O、Al2(SO4)3等.(溶液中Cr2O72-的浓度可用仪器测定)
| 实验方案(不要求写具体操作过程) | 预期实验结果和结论 |
| 取等物质的量的K2SO4•Al2(SO4)3•24H2O代替实验①中的铁明矾,控制其他反条件与实验①相同,进行对比实验. | 反应进行相同时间后, 若溶液中的Cr2O72-浓度大于 实验①中的Cr2O72的浓度,则假设一成立; 若溶液中的Cr2O72-浓度等于 实验①中的Cr2O72的浓度,则假设一不成立. |
| 组数 | 1 | 2 | 3 | 4 |
| 消耗V(KMnO4)/ml | 20.04 | 20.00 | 18.90 | 19.96 |
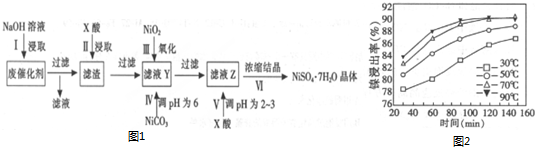
部分阳离子以氢氧物形式完全沉淀时的pH如下:
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
| pH | 5.2 | 3.2 | 9.7 | 9.2 |
(1)第1步加入NaOH溶液的目的是除去Al、Al2O3和油脂等杂质.
(2)“酸浸”时所加入的X酸是硫酸(填化学式).保持其他条件相同,在不同温度下对废镍催化剂进行“酸浸”,镍浸出率随时间变化如图2,“酸浸”的适宜温度与时间分别是C(填选项字母).
A.30℃、30min B.90℃、150min C.70℃、120min
(3)第V步调pH为2~3的目的是(请结合化学用语和平衡移动原理解释)溶液中存在水解平衡Ni2++2H2O?Ni(OH)2+2H+,增大氢离子浓度平衡逆向进行避免浓缩过程中水解生成沉淀.
(4)工业上以铝和NiOOH为电极,NaOH溶液为电解液制成电池.放电时,NiOOH转化为Ni(OH)2,该电池正极反应式是NiO(OH)+H2O+e-═Ni(OH)2+OH-.
(5)已知:2Mg(s)+O2(g)=2Mg(s)△H1=-2075kJ/mol
Mg2Ni(s)+2MgH2(s)=2Mg(s)+Mg2NiH4(s)△H2=+84.6kJ/mol
MgH2(s)+$\frac{1}{2}$O2(g)=MgO(s)+H2(g)△H3=-963kJ/mol
含镍储氢材料(Mg2NiH4)释放氢气和Mg2Ni的热化学方程式是Mg2NiH4(s)=Mg2Ni(s)+2H2(g)△H=+64.4KJ/mol.
(6)在含镍废催化剂中,Ni、Al和Fe的质量分数分别是29.5%、31%和5.6%.a kg含镍废催化剂按上述流程转化,第Ⅱ步加入cmol/L的X酸bL,酸浸后的滤液Y不含Fe3+,滤液Z中残留的酸忽略不计,则第Ⅳ步应加入NiCO30.119(cb-5.5a)kg.
| A. | 2,2-二甲基-1-丙醇和2-甲基-1-丁醇 | |
| B. | 对氯甲苯和邻氯甲苯 | |
| C. | 2-甲基丁烷和戊烷 | |
| D. | 甲基丙烯酸和甲酸丙酯 |
| A. | IA族与ⅦA族元素间形成的化合物都是离子化合物 | |
| B. | 第三周期元素从左到右,最高正价从+1递增到+7 | |
| C. | 同主族元素的简单阴离子从上到下还原性减弱 | |
| D. | 同周期金属元素的化合价越高,其原子失电子能力越强 |