题目内容
17.土卫六“泰坦”拥有丰富的碳氢燃料资源.“泰坦”的碳氢化合物循环在一定程度上与地球的水循环类似,以甲烷雨和碳氢雾的形式出现,或者以液态甲烷和乙烷湖的形式存在于地表,下列有关说法正确的是( )| A. | 碳氢化合物就是烃 | |
| B. | 水、甲烷和乙烷都是10个电子的分子 | |
| C. | 乙烷的沸点比甲烷高,因而更难液化 | |
| D. | 甲烷和乙烷分子中只有一种氢,故其二氯化物也只有一种 |
分析 A.依据烃的概念判断;
B.乙烷分子式为C2H6,1个乙烷分子含有18个电子;
C.烷烃中碳原子数目越多沸点越高;
D.甲烷为正四面体结构,二氯代物只有一种,乙烷含有6个氢原子,两个氯原子可以连接在同一个碳上,也可以连接在不同碳上.
解答 解:A.烃是完全由C,H组成的有机物质,所以碳氢化合物就是烃,故A正确;
B.水、甲烷都是10个电子的分子,乙烷含有18个电子,故B错误;
C.乙烷含有2个碳原子,甲烷含有1个碳原子,烷烃中碳原子数目越多沸点越高,所以乙烷沸点高于甲烷,气体沸点越高越易液化,故C错误;
D.甲烷为正四面体结构,所以二氯甲烷只有一种,二氯乙烷有两种,分别为1,1-二氯甲烷,1,2-二氯乙烷,故D错误;
故选:A.
点评 本题考查了烃的概念、烷烃沸点高低判断、烷烃二氯代物种数判断,明确烃的概念、烷烃的结构特点及沸点规律是解题关键,题目难度不大.

练习册系列答案
 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案
相关题目
8.下列说法错误的是( )
| A. | 二氧化碳和漂白粉作用,生成具有氧化性的物质 | |
| B. | 二氧化硫通入氢硫酸中,使溶液的酸性一定减弱 | |
| C. | 二氧化硫和烧碱反应,使溶液的碱性一定减弱 | |
| D. | 二氧化氮可相互结合为四氧化二氦氮 |
12.用下列步骤制取物质,可以达到目的是( )
| A. | Al$\stackrel{氧气,加热}{→}$Al2O3$\stackrel{硝酸}{→}$Al(NO3)3$\stackrel{加热蒸干}{→}$硝酸铝晶体 | |
| B. | Cu$\stackrel{氧气,加热}{→}$CuO$\stackrel{稀硫酸}{→}$CuSO4$\stackrel{蒸干结晶}{→}$胆矾 | |
| C. | Fe$\stackrel{氯气}{→}$FeCl3$\stackrel{过量氨水}{→}$Fe(OH)3$\stackrel{加热}{→}$Fe2O3 | |
| D. | FeSO4溶液$\stackrel{硫化氢、过滤}{→}$FeS |
3.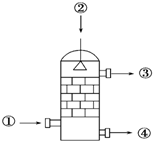 在硫酸工业生产中,SO3的吸收过程是在吸收塔(如图)中进行的,吸收塔里还装入了大量瓷环.下列说法中不正确的是( )
在硫酸工业生产中,SO3的吸收过程是在吸收塔(如图)中进行的,吸收塔里还装入了大量瓷环.下列说法中不正确的是( )
 在硫酸工业生产中,SO3的吸收过程是在吸收塔(如图)中进行的,吸收塔里还装入了大量瓷环.下列说法中不正确的是( )
在硫酸工业生产中,SO3的吸收过程是在吸收塔(如图)中进行的,吸收塔里还装入了大量瓷环.下列说法中不正确的是( )| A. | 从①处通入SO3,整个吸收操作采取逆流的形式 | |
| B. | 从②处喷下98.3%的硫酸,瓷环的作用是增大接触面积 | |
| C. | 从③处导出的气体只含有少量SO2,可直接排入大气 | |
| D. | 从④处流出的是可用水或稀硫酸稀释的浓硫酸 |
10.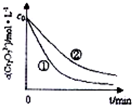 某酸性工业废水中含有K2Cr2O7.光照下,草酸(H2C2O4)能将其中的Cr2O72-转化为Cr2+.某课题组研究发现,少量铁明矾[Al2Fe(SO4)4•4H2O]即可对该反应起催化作用,为进一步研究有关因素对该反应速率的影响,探究如下:
某酸性工业废水中含有K2Cr2O7.光照下,草酸(H2C2O4)能将其中的Cr2O72-转化为Cr2+.某课题组研究发现,少量铁明矾[Al2Fe(SO4)4•4H2O]即可对该反应起催化作用,为进一步研究有关因素对该反应速率的影响,探究如下:
(1)在25℃下,控制光照强度、废水样品初始浓度和催化剂用量相同,调节不同的初始pH和一定浓度草酸溶液用量,作对比实验,完成以下实验设计表(表中不要留空格).
测得实验①和②溶液中的Cr2O72-随时间变化关系如图所示.
(2)上述反应后草酸被氧化为CO2(填化学式);
(3)实验①和②的结果表明,其他条件不变时,溶液的pH越小,反应速率越快;
(4)该课题组对铁明矾[Al2Fe(SO4)4•4H2O]中起催化作用的成分提出如下假设,请你完成假设三:
假设一:Fe2+起催化作用;
假设二:Al3+起催化作用
假设三:SO42-起催化作用.
(5)请你设计实验验证上述假设一,完成下表中内容.(除了上述实验提供的试剂外,可供选择的药品有K2SO4、FeSO4、K2SO4•Al2(SO4)3•24H2O、Al2(SO4)3等.(溶液中Cr2O72-的浓度可用仪器测定)
(6)铁明矾长期存放,其中的亚铁离子可能会变质.为测定铁明矾中亚铁离子的质量分数.取5.6g铁明矾晶体,将其配制为100ml的溶液,取出20ml置于锥形瓶中,用0.01mol•L-1的 标准KMnO4溶液进行滴定(还原产物为Mn2+),平行做4组实验,得出如下表数值.
则明矾中亚铁离子的质量分数:5.00%(保留小数点后2位有效数字).若滴定结束后读书时俯视,测定结果偏小(填“偏大”、“不影响”或“偏小”).[相对原子质量Fe:56].
 某酸性工业废水中含有K2Cr2O7.光照下,草酸(H2C2O4)能将其中的Cr2O72-转化为Cr2+.某课题组研究发现,少量铁明矾[Al2Fe(SO4)4•4H2O]即可对该反应起催化作用,为进一步研究有关因素对该反应速率的影响,探究如下:
某酸性工业废水中含有K2Cr2O7.光照下,草酸(H2C2O4)能将其中的Cr2O72-转化为Cr2+.某课题组研究发现,少量铁明矾[Al2Fe(SO4)4•4H2O]即可对该反应起催化作用,为进一步研究有关因素对该反应速率的影响,探究如下:(1)在25℃下,控制光照强度、废水样品初始浓度和催化剂用量相同,调节不同的初始pH和一定浓度草酸溶液用量,作对比实验,完成以下实验设计表(表中不要留空格).
| 实验编号 | 初始pH | 废水样品体积/mL | 草酸溶液体积/mL | 蒸馏水体积/mL |
| ① | 4 | a=60 | 10 | 30 |
| ② | 5 | 60 | 10 | c=30 |
| ③ | 5 | 60 | b=20 | 20 |
(2)上述反应后草酸被氧化为CO2(填化学式);
(3)实验①和②的结果表明,其他条件不变时,溶液的pH越小,反应速率越快;
(4)该课题组对铁明矾[Al2Fe(SO4)4•4H2O]中起催化作用的成分提出如下假设,请你完成假设三:
假设一:Fe2+起催化作用;
假设二:Al3+起催化作用
假设三:SO42-起催化作用.
(5)请你设计实验验证上述假设一,完成下表中内容.(除了上述实验提供的试剂外,可供选择的药品有K2SO4、FeSO4、K2SO4•Al2(SO4)3•24H2O、Al2(SO4)3等.(溶液中Cr2O72-的浓度可用仪器测定)
| 实验方案(不要求写具体操作过程) | 预期实验结果和结论 |
| 取等物质的量的K2SO4•Al2(SO4)3•24H2O代替实验①中的铁明矾,控制其他反条件与实验①相同,进行对比实验. | 反应进行相同时间后, 若溶液中的Cr2O72-浓度大于 实验①中的Cr2O72的浓度,则假设一成立; 若溶液中的Cr2O72-浓度等于 实验①中的Cr2O72的浓度,则假设一不成立. |
| 组数 | 1 | 2 | 3 | 4 |
| 消耗V(KMnO4)/ml | 20.04 | 20.00 | 18.90 | 19.96 |
 “立方烷”是一种人工合成的烃,其分子为正方体结构,其碳架结构如图所示:
“立方烷”是一种人工合成的烃,其分子为正方体结构,其碳架结构如图所示: .
.