题目内容
19.少量铁粉与100mL 0.01mol•L-1的稀盐酸反应,反应速率太慢.为了加快此反应速率而不改变H2的产量,可以使用如下方法的( )①加H2O
②滴入几滴浓HNO3
③滴入几滴浓盐酸
④加CH3COONa固体
⑤加NaCl固体
⑥升高温度(不考虑盐酸挥发)
⑦改用10mL 0.1mol•L-1盐酸.
| A. | ②⑥⑦ | B. | ③⑤⑦ | C. | ③⑥⑦ | D. | ②③⑦ |
分析 为了加快此反应速率而不改变H2的产量,则升高温度、增大浓度、构成原电池等均可加快反应,但不能改变氢离子的物质的量,以此来解答.
解答 解:①加水,稀释了盐酸,故反应速率变慢,故不选;
②加入硝酸,不再生成氢气而是生成氮的氧化物,故不选;
③加浓盐酸,盐酸浓度增大,反应速率加快,Fe少量完全反应生成氢气不变,故选;
④加CH3COONa固体,氢离子浓度减小,反应速率减小,故不选;
⑤加氯化钠固体,对反应速率无影响,故不选;
⑥升高温度,反应速率加快,不影响氢气的量,故选;
⑦改用浓度大的盐酸,反应速率加快,Fe少量完全反应生成氢气不变,故选;
故选C.
点评 本题考查化学反应速率的影响因素,为高频考点,把握浓度、温度对反应速率的影响为解答的关键,侧重分析与应用能力的考查,注意硝酸的性质,题目难度不大.

练习册系列答案
相关题目
9.一定温度下,对反应2A(g)+B(s)?2C(g)能说明其达到平衡状态的是( )
| A. | 容积中A、B、C三者共存 | |
| B. | 单位时间内反应的A与生成的C的物质的量之比为1:1 | |
| C. | c(A):c(B):c(C)=2:1:2 | |
| D. | 气体的总质量不再发生变化 |
10.下列说法正确的是( )
| A. | 0.1mol•L-1的醋酸加水稀释,$\frac{c({H}^{+})}{c(O{H}^{-})}$减小 | |
| B. | 向水中加入少量固体硫酸氢钠,c(H+)增大,KW变大 | |
| C. | 体积、pH均相同的醋酸和盐酸完全溶解等量的镁粉(少量)后者用时少 | |
| D. | 常温下,pH=11的NaOH溶液与pH=3的CH3COOH溶液等体积混合,溶液显碱性 |
4.用萃取法从碘水中分离碘,所用萃取剂应具有的性质是( )
①不和碘或水起化学反应 ②能溶于水 ③不溶于水 ④应是极性溶剂 ⑤应是非极性溶剂.
①不和碘或水起化学反应 ②能溶于水 ③不溶于水 ④应是极性溶剂 ⑤应是非极性溶剂.
| A. | ①②⑤ | B. | ②③④ | C. | ①③⑤ | D. | ①③④ |
11.A、B、C、D、E是核电荷数依次增大的五种短周期主族元素,原子半径按D、E、B、C、A顺序依次减小,B和E是同族,则下列推断中正确的是( )
| A. | A、B、E一定处于1、2、3三个不同周期 | |
| B. | A、D不可能在同一主族 | |
| C. | C的最高氧化物的水化物可能显碱性 | |
| D. | C和D的单质不可能化合成1:1型离子化合物 |
8.下列说法错误的是( )
| A. | 二氧化碳和漂白粉作用,生成具有氧化性的物质 | |
| B. | 二氧化硫通入氢硫酸中,使溶液的酸性一定减弱 | |
| C. | 二氧化硫和烧碱反应,使溶液的碱性一定减弱 | |
| D. | 二氧化氮可相互结合为四氧化二氦氮 |
10.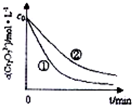 某酸性工业废水中含有K2Cr2O7.光照下,草酸(H2C2O4)能将其中的Cr2O72-转化为Cr2+.某课题组研究发现,少量铁明矾[Al2Fe(SO4)4•4H2O]即可对该反应起催化作用,为进一步研究有关因素对该反应速率的影响,探究如下:
某酸性工业废水中含有K2Cr2O7.光照下,草酸(H2C2O4)能将其中的Cr2O72-转化为Cr2+.某课题组研究发现,少量铁明矾[Al2Fe(SO4)4•4H2O]即可对该反应起催化作用,为进一步研究有关因素对该反应速率的影响,探究如下:
(1)在25℃下,控制光照强度、废水样品初始浓度和催化剂用量相同,调节不同的初始pH和一定浓度草酸溶液用量,作对比实验,完成以下实验设计表(表中不要留空格).
测得实验①和②溶液中的Cr2O72-随时间变化关系如图所示.
(2)上述反应后草酸被氧化为CO2(填化学式);
(3)实验①和②的结果表明,其他条件不变时,溶液的pH越小,反应速率越快;
(4)该课题组对铁明矾[Al2Fe(SO4)4•4H2O]中起催化作用的成分提出如下假设,请你完成假设三:
假设一:Fe2+起催化作用;
假设二:Al3+起催化作用
假设三:SO42-起催化作用.
(5)请你设计实验验证上述假设一,完成下表中内容.(除了上述实验提供的试剂外,可供选择的药品有K2SO4、FeSO4、K2SO4•Al2(SO4)3•24H2O、Al2(SO4)3等.(溶液中Cr2O72-的浓度可用仪器测定)
(6)铁明矾长期存放,其中的亚铁离子可能会变质.为测定铁明矾中亚铁离子的质量分数.取5.6g铁明矾晶体,将其配制为100ml的溶液,取出20ml置于锥形瓶中,用0.01mol•L-1的 标准KMnO4溶液进行滴定(还原产物为Mn2+),平行做4组实验,得出如下表数值.
则明矾中亚铁离子的质量分数:5.00%(保留小数点后2位有效数字).若滴定结束后读书时俯视,测定结果偏小(填“偏大”、“不影响”或“偏小”).[相对原子质量Fe:56].
 某酸性工业废水中含有K2Cr2O7.光照下,草酸(H2C2O4)能将其中的Cr2O72-转化为Cr2+.某课题组研究发现,少量铁明矾[Al2Fe(SO4)4•4H2O]即可对该反应起催化作用,为进一步研究有关因素对该反应速率的影响,探究如下:
某酸性工业废水中含有K2Cr2O7.光照下,草酸(H2C2O4)能将其中的Cr2O72-转化为Cr2+.某课题组研究发现,少量铁明矾[Al2Fe(SO4)4•4H2O]即可对该反应起催化作用,为进一步研究有关因素对该反应速率的影响,探究如下:(1)在25℃下,控制光照强度、废水样品初始浓度和催化剂用量相同,调节不同的初始pH和一定浓度草酸溶液用量,作对比实验,完成以下实验设计表(表中不要留空格).
| 实验编号 | 初始pH | 废水样品体积/mL | 草酸溶液体积/mL | 蒸馏水体积/mL |
| ① | 4 | a=60 | 10 | 30 |
| ② | 5 | 60 | 10 | c=30 |
| ③ | 5 | 60 | b=20 | 20 |
(2)上述反应后草酸被氧化为CO2(填化学式);
(3)实验①和②的结果表明,其他条件不变时,溶液的pH越小,反应速率越快;
(4)该课题组对铁明矾[Al2Fe(SO4)4•4H2O]中起催化作用的成分提出如下假设,请你完成假设三:
假设一:Fe2+起催化作用;
假设二:Al3+起催化作用
假设三:SO42-起催化作用.
(5)请你设计实验验证上述假设一,完成下表中内容.(除了上述实验提供的试剂外,可供选择的药品有K2SO4、FeSO4、K2SO4•Al2(SO4)3•24H2O、Al2(SO4)3等.(溶液中Cr2O72-的浓度可用仪器测定)
| 实验方案(不要求写具体操作过程) | 预期实验结果和结论 |
| 取等物质的量的K2SO4•Al2(SO4)3•24H2O代替实验①中的铁明矾,控制其他反条件与实验①相同,进行对比实验. | 反应进行相同时间后, 若溶液中的Cr2O72-浓度大于 实验①中的Cr2O72的浓度,则假设一成立; 若溶液中的Cr2O72-浓度等于 实验①中的Cr2O72的浓度,则假设一不成立. |
| 组数 | 1 | 2 | 3 | 4 |
| 消耗V(KMnO4)/ml | 20.04 | 20.00 | 18.90 | 19.96 |
 .
.