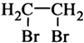题目内容
短周期元素X、Y、Z的原子序数依次递增,其原子的最外层电子数之和为13.X与Y、Z位于相邻周期,Z原子最外层电子数是X原子内层电子数的3倍或者是Y原子最外层电子数的3倍.下列说法正确的是( )
| A、X的氢化物溶于水显酸性 |
| B、X与Y形成化合物的化学式为X2Y3 |
| C、Y的氧化物是离子化合物 |
| D、X和Z的最高价氧化物对应的水化物都是弱酸 |
考点:原子结构与元素的性质
专题:
分析:短周期元素X、Y、Z的原子序数依次递增,Z原子最外层电子数是X原子内层电子数的3倍或者Y原子最外层电子数的3倍,则X的内层电子数为2,Z的最外层电子数为6,Y的最外层电子数为2,原子的最外层电子数之和为13,则X的最外层电子数为13-6-2=5,所以X为N,Y为Mg,Z为S,结合元素及其化合物来解答.
解答:
解:短周期元素X、Y、Z的原子序数依次递增,Z原子最外层电子数是X原子内层电子数的3倍或者Y原子最外层电子数的3倍,则X的内层电子数为2,Z的最外层电子数为6,Y的最外层电子数为2,原子的最外层电子数之和为13,则X的最外层电子数为13-6-2=5,所以X为N,Y为Mg,Z为S,
A.X为N元素,N的氢化物为氨气,溶于水显碱性,故A错误;
B.X为N,Y为Mg,N显-3价,Mg显+2价,则X与Y形成化合物的化学式为Y3X2,故B错误;
C.Y为Mg,其氧化物为MgO,属于离子化合物,故C正确;
D.X和Z的最高价氧化物对应的水化物分别为硝酸、硫酸,都是强酸,故D错误;
故选C.
A.X为N元素,N的氢化物为氨气,溶于水显碱性,故A错误;
B.X为N,Y为Mg,N显-3价,Mg显+2价,则X与Y形成化合物的化学式为Y3X2,故B错误;
C.Y为Mg,其氧化物为MgO,属于离子化合物,故C正确;
D.X和Z的最高价氧化物对应的水化物分别为硝酸、硫酸,都是强酸,故D错误;
故选C.
点评:本题考查原子结构、元素周期律,利用原子结构来推断元素是解答本题的关键,注意短周期元素的内层电子只能为2或8,题目难度不大.

练习册系列答案
 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案
相关题目
分析以下几个热化学方程式,能表示燃烧热的是( )
| A、C(s)+O2(g)═CO(g)△H=-110.5 kJ/mol | ||
| B、C(s)+O2(g)═CO2(g)△H=-393.5 kJ/mol | ||
| C、2H2 (g)+O2(g)═2H2O(l)△H=-571.6 kJ/mol | ||
D、H2(g)+
|
等质量的下列气体所含原子数最多的是( )
| A、C2H6 |
| B、CH4 |
| C、CO |
| D、H2 |
常温时,0.01mol?L-1某一元弱酸的电离常数Ka=10-6,则下列说法正确的是( )
| A、上述弱酸溶液的pH≈4 |
| B、加入NaOH溶液后,弱酸的电离平衡向右移动,Ka值增大 |
| C、加水稀释后,溶液中所有分子、离子浓度都减小 |
| D、加入等体积0.01 mol?L-1 NaOH溶液后,所得溶液的pH<7 |
灰锡(以粉末状存在)和白锡是锡的两种同素异形体.已知:
①Sn(s、白)+2HCl(aq)═SnCl2(aq)+H2(g)△H1
②Sn(s、灰)+2HCl(aq)═SnCl2(aq)+H2(g)△H2
③Sn(s、灰) Sn(s、白)△H3=+2.1kJ/mol,下列说法正确的是( )
Sn(s、白)△H3=+2.1kJ/mol,下列说法正确的是( )
①Sn(s、白)+2HCl(aq)═SnCl2(aq)+H2(g)△H1
②Sn(s、灰)+2HCl(aq)═SnCl2(aq)+H2(g)△H2
③Sn(s、灰)
 Sn(s、白)△H3=+2.1kJ/mol,下列说法正确的是( )
Sn(s、白)△H3=+2.1kJ/mol,下列说法正确的是( )| A、△H1>△H2 |
| B、锡制器皿长期处于低于13.2℃的环境中,会自行毁坏 |
| C、锡在常温下以灰锡状态存在 |
| D、灰锡转化为白锡的反应是放热反应 |
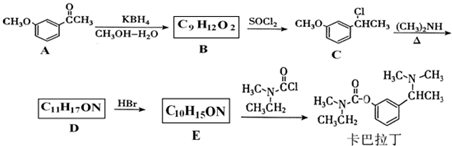
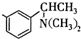 基团 ②属于α-氨基酸 ③含有三个手性碳原子.
基团 ②属于α-氨基酸 ③含有三个手性碳原子.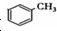 )和丙酮(
)和丙酮(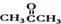 ) 制备化合物
) 制备化合物 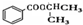 的合成路线流程图(无机试剂任选).合成路线流程图示例如下:CH3CH2OH
的合成路线流程图(无机试剂任选).合成路线流程图示例如下:CH3CH2OH