题目内容
将标况下4升NO2和1升O2混合充满烧瓶,然后倒插入水槽中,溶液的物质的量浓度是多少?(假设硝酸未进入水槽)若是4升NO和3升O2,浓度又是多少?若是NO2、NO、O2的混合气体,也是刚好溶于水完全反应,则溶液的浓度在什么范围?
考点:有关混合物反应的计算
专题:计算题
分析:结合4NO2+O2+2H2O=4HNO3、4NO+3O2+2H2O=4HNO3及体积比等于物质的量比可知,溶质为硝酸,结合c=
计算.
| n |
| V |
解答:
解:标况下4升NO2和1升O2混合充满烧瓶,然后倒插入水槽中,发生4NO2+O2+2H2O=4HNO3,硝酸的物质的量为
mol,溶液的物质的量浓度是
=0.036mol/L;
若是4升NO和3升O2,发生4NO+3O2+2H2O=4HNO3,硝酸的物质的量为
mol,溶液的物质的量浓度是
=0.026mol/L,
则若是NO2、NO、O2的混合气体,也是刚好溶于水完全反应,则溶液的浓度在0.26mol/L~0.036mol/L之间,
答:浓度分别为0.036mol/L、0.026mol/L、0.26mol/L~0.036mol/L之间.
| 4 |
| 22.4 |
| ||
| 5L |
若是4升NO和3升O2,发生4NO+3O2+2H2O=4HNO3,硝酸的物质的量为
| 4 |
| 22.4 |
| ||
| 7L |
则若是NO2、NO、O2的混合气体,也是刚好溶于水完全反应,则溶液的浓度在0.26mol/L~0.036mol/L之间,
答:浓度分别为0.036mol/L、0.026mol/L、0.26mol/L~0.036mol/L之间.
点评:本题考查混合物的计算,为高频考点,把握发生的反应、物质的量关系为解答的关键,注意气体恰好反应没有剩余,侧重分析与计算能力的考查,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
短周期元素X、Y、Z的原子序数依次递增,其原子的最外层电子数之和为13.X与Y、Z位于相邻周期,Z原子最外层电子数是X原子内层电子数的3倍或者是Y原子最外层电子数的3倍.下列说法正确的是( )
| A、X的氢化物溶于水显酸性 |
| B、X与Y形成化合物的化学式为X2Y3 |
| C、Y的氧化物是离子化合物 |
| D、X和Z的最高价氧化物对应的水化物都是弱酸 |
常温下,某溶液中由水电离出的出c(H+)=1.0×10-13mol/L则在该溶液中一定不可以大量共存的一组离子是( )
| A、NH4+、NO3-、K+、SO42- |
| B、CO32_、NO3-、HCO3-、Na+ |
| C、Na+、ClO-、AlO2-、NO3- |
| D、MnO4-、K+、Na+、SO42- |
把3molP和2.5molQ置于2L密闭容器中发生如下反应:3P(g)+Q(g)?xM(g)+2N(g) 经5mim反应达平衡时,测知生成1molN,M的平均反应速率为0.1mol/(L.min),下列叙述错误的是( )
| A、P的平均反应速率为0.15 mol/(L.min) |
| B、Q的转化率为25% |
| C、Q的平衡浓度为1mol/L |
| D、x的值是2 |
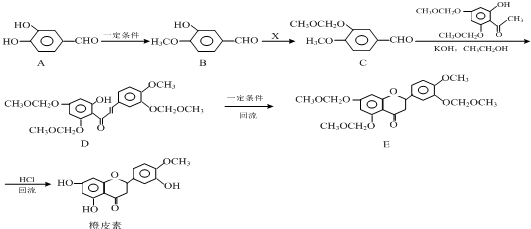
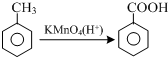 结合流程信息,写出以对甲基苯酚和上述流程中的“X”为原料,制备
结合流程信息,写出以对甲基苯酚和上述流程中的“X”为原料,制备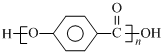 的合成路线流程图(无机试剂任选).合成路线流程图示例如下:
的合成路线流程图(无机试剂任选).合成路线流程图示例如下:
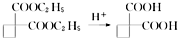 ,请你设计出合理的反应流程图.
,请你设计出合理的反应流程图.
 )属于香豆素类化合物,具有抗菌抗癌作用.该化合物是香豆素(
)属于香豆素类化合物,具有抗菌抗癌作用.该化合物是香豆素( )的衍生物,可由4-羟基水杨醛和乙酸酐制得:
)的衍生物,可由4-羟基水杨醛和乙酸酐制得:

 与乙酸酐反应制得,试写出该反应的化学方程式
与乙酸酐反应制得,试写出该反应的化学方程式