题目内容
常温时,0.01mol?L-1某一元弱酸的电离常数Ka=10-6,则下列说法正确的是( )
| A、上述弱酸溶液的pH≈4 |
| B、加入NaOH溶液后,弱酸的电离平衡向右移动,Ka值增大 |
| C、加水稀释后,溶液中所有分子、离子浓度都减小 |
| D、加入等体积0.01 mol?L-1 NaOH溶液后,所得溶液的pH<7 |
考点:弱电解质在水溶液中的电离平衡
专题:
分析:A.根据电离平衡常数计算氢离子浓度;
B.电离平衡常数只与温度有关,与溶液的酸碱性无关;
C.加水稀释后,促进电离,溶液中显性离子和弱酸分子浓度减小,但氢氧根离子浓度增大;
D.等体积等浓度的一元酸碱混合,根据盐的类型判断溶液的酸碱性.
B.电离平衡常数只与温度有关,与溶液的酸碱性无关;
C.加水稀释后,促进电离,溶液中显性离子和弱酸分子浓度减小,但氢氧根离子浓度增大;
D.等体积等浓度的一元酸碱混合,根据盐的类型判断溶液的酸碱性.
解答:
解:A.c(H+)=
=
=10-4 mol/L,所以溶液的pH=4,故A正确;
B.酸的电离平衡常数只与温度有关,与溶液的酸碱性无关,所以向酸中加入氢氧化钠溶液虽然促进弱酸电离,但电离平衡常数不变,故B错误;
C.加水稀释后,促进电离,溶液中显性离子和弱酸分子浓度减小,但氢氧根离子浓度增大,故C错误;
D.等体积等浓度的该酸和氢氧化钠恰好反应生成强碱弱酸盐,溶液呈碱性,pH>7,故D错误;
故选A.
| Ka.c |
| 10-6×0.01 |
B.酸的电离平衡常数只与温度有关,与溶液的酸碱性无关,所以向酸中加入氢氧化钠溶液虽然促进弱酸电离,但电离平衡常数不变,故B错误;
C.加水稀释后,促进电离,溶液中显性离子和弱酸分子浓度减小,但氢氧根离子浓度增大,故C错误;
D.等体积等浓度的该酸和氢氧化钠恰好反应生成强碱弱酸盐,溶液呈碱性,pH>7,故D错误;
故选A.
点评:本题考查弱电解质的电离,根据盐的类型、氢离子浓度来分析解答即可,注意电离平衡常数只与温度有关,为易错点.

练习册系列答案
相关题目
 已知:2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ/mol,下列说法不正确的是( )
已知:2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ/mol,下列说法不正确的是( )| A、该反应原理可用于设计氢氧燃料电池 | ||
| B、破坏1 mol H-O 键需要的能量是463.4 kJ | ||
C、H2O(g)=H2(g)+
| ||
| D、H2(g) 中的H-H 键比 H2O(g) 中的H-O 键牢固 |
已知G、Q、X、Y、Z均为含氯元素的化合物,在一定条件下有下列转化关系(未配平):
①G-→Q+NaCl
②Q+H2O
X+H2
③Y+NaOH-→G+Q+H2O
④Z+NaOH-→Q+X+H2O
这五种化合物中Cl元素化合价由低到高的顺序是( )
①G-→Q+NaCl
②Q+H2O
| ||
③Y+NaOH-→G+Q+H2O
④Z+NaOH-→Q+X+H2O
这五种化合物中Cl元素化合价由低到高的顺序是( )
| A、G、Y、Q、Z、X |
| B、X、Z、Q、G、Y |
| C、X、Z、Q、Y、G |
| D、G、Q、Y、Z、X |
短周期元素X、Y、Z的原子序数依次递增,其原子的最外层电子数之和为13.X与Y、Z位于相邻周期,Z原子最外层电子数是X原子内层电子数的3倍或者是Y原子最外层电子数的3倍.下列说法正确的是( )
| A、X的氢化物溶于水显酸性 |
| B、X与Y形成化合物的化学式为X2Y3 |
| C、Y的氧化物是离子化合物 |
| D、X和Z的最高价氧化物对应的水化物都是弱酸 |
下列指定反应的离子方程式正确的是( )
| A、铜溶于稀硝酸:Cu+2H++NO3-=Cu2++NO2↑+H2O |
| B、氯气和水的反应:Cl2+H2O=2H++Cl-+ClO- |
| C、用氨水溶解氯化银沉淀:Ag++2NH3?H2O=[Ag(NH3)2]++2H2O |
| D、将过量二氧化硫通入氨水中:SO2+NH3?H2O=HSO3-+NH4+ |
把3molP和2.5molQ置于2L密闭容器中发生如下反应:3P(g)+Q(g)?xM(g)+2N(g) 经5mim反应达平衡时,测知生成1molN,M的平均反应速率为0.1mol/(L.min),下列叙述错误的是( )
| A、P的平均反应速率为0.15 mol/(L.min) |
| B、Q的转化率为25% |
| C、Q的平衡浓度为1mol/L |
| D、x的值是2 |
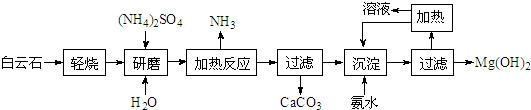

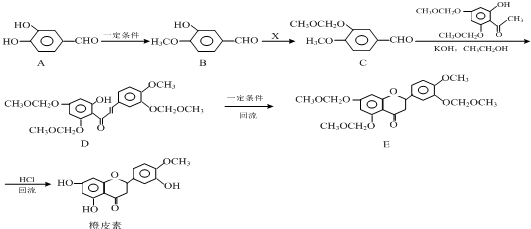
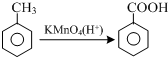 结合流程信息,写出以对甲基苯酚和上述流程中的“X”为原料,制备
结合流程信息,写出以对甲基苯酚和上述流程中的“X”为原料,制备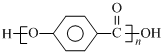 的合成路线流程图(无机试剂任选).合成路线流程图示例如下:
的合成路线流程图(无机试剂任选).合成路线流程图示例如下: