题目内容
已知:①1mol H2分子中化学键断裂时需要吸收436kJ的能量,②1mol Cl2分子中化学键断裂时需要吸收243kJ的能量,③形成1mol HCl分子时释放431kJ的能量.求氢气和氯气反应生成2mol氯化氢气体的△H= kJ?mol-1.
考点:有关反应热的计算
专题:
分析:根据反应热等于反应物的总键能-生成物的总键来解答.
解答:
解:H2(g)+Cl2(g)=2HCl(g)的反应热=生成物的键能减反应物的键能=436kJ?mol-1+243kJ?mol-1-2×431 kJ?mol-1=-183kJ?mol-1,故1mol氢气与1mol氯气反应生成2mol氯化氢气体的△H=-183kJ?mol-1,
故答案为:-183.
故答案为:-183.
点评:本题主要考查了反应热的计算,难度不大,根据反应热等于反应物的总键能-生成物的总键即可完成.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列废弃物,可直接回收利用的是( )
| A、易拉罐 | B、可充电电池 |
| C、玻璃白酒瓶 | D、医用点滴管 |
 已知:2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ/mol,下列说法不正确的是( )
已知:2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ/mol,下列说法不正确的是( )| A、该反应原理可用于设计氢氧燃料电池 | ||
| B、破坏1 mol H-O 键需要的能量是463.4 kJ | ||
C、H2O(g)=H2(g)+
| ||
| D、H2(g) 中的H-H 键比 H2O(g) 中的H-O 键牢固 |
下列说法中正确的是(NA表示阿伏加德罗常数)( )
| A、4℃时,5.4mL水中所含的水分子数是0.3NA(4℃时,水的密度为1.0g/ml) |
| B、在常温常压下,11.2L氯气所含的原子数为NA |
| C、标准状况下,22.4L氢气所含的质子数为 NA |
| D、2L 1mol?L-1K2SO4溶液中离子的总数为3 NA |
下列说法正确的是( )
| A、H2的摩尔质量是2mol |
| B、CO2的摩尔质量是44g/mol |
| C、1mol的氧 |
| D、3molO2的摩尔质量为96g/mol |
某溶液由NaCl、MgCl2、Al2(SO4)3、Na2SO4组成,已知c(Na+)=0.4mol/L,c(Al3+)=0.2mol/L,c(Mg2+)=0.1mol/L,c(Cl-)=0.3mol/L,则SO42-物质的量浓度为( )
| A、0.3mol/L |
| B、0.4mol/L |
| C、0.45mol/L |
| D、0.55mol/L |
已知G、Q、X、Y、Z均为含氯元素的化合物,在一定条件下有下列转化关系(未配平):
①G-→Q+NaCl
②Q+H2O
X+H2
③Y+NaOH-→G+Q+H2O
④Z+NaOH-→Q+X+H2O
这五种化合物中Cl元素化合价由低到高的顺序是( )
①G-→Q+NaCl
②Q+H2O
| ||
③Y+NaOH-→G+Q+H2O
④Z+NaOH-→Q+X+H2O
这五种化合物中Cl元素化合价由低到高的顺序是( )
| A、G、Y、Q、Z、X |
| B、X、Z、Q、G、Y |
| C、X、Z、Q、Y、G |
| D、G、Q、Y、Z、X |
短周期元素X、Y、Z的原子序数依次递增,其原子的最外层电子数之和为13.X与Y、Z位于相邻周期,Z原子最外层电子数是X原子内层电子数的3倍或者是Y原子最外层电子数的3倍.下列说法正确的是( )
| A、X的氢化物溶于水显酸性 |
| B、X与Y形成化合物的化学式为X2Y3 |
| C、Y的氧化物是离子化合物 |
| D、X和Z的最高价氧化物对应的水化物都是弱酸 |
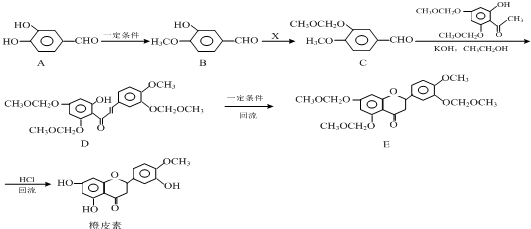
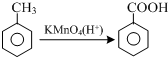 结合流程信息,写出以对甲基苯酚和上述流程中的“X”为原料,制备
结合流程信息,写出以对甲基苯酚和上述流程中的“X”为原料,制备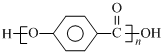 的合成路线流程图(无机试剂任选).合成路线流程图示例如下:
的合成路线流程图(无机试剂任选).合成路线流程图示例如下: