题目内容
6.由 NaHS、MgSO4、NaHSO3 组成的混合物中,已知硫元素的质量分数w(S)=a%,则氧元素的质量分数w(O)为( )| A. | 1.75a% | B. | 1.25a% | C. | 1-1.75a% | D. | 1-1.25a% |
分析 NaHS、NaHSO3中“NaH”的总相对原子质量为24,与1个Mg原子的相对原子质量相等,所以可以从质量角度将“NaH”视为一个与Mg等效的整体A(即将“NaH”和Mg都换用“A”来表示,可看作其相对原子质量为24).那么,这样处理后混合物就相当于是由AS、ASO4、ASO3组成的了,而此时的混合物中A、S原子个数比为1:1,二者的质量比为24:32;利用硫元素的质量分数可求得A的质量分数,混合物中氧元素的质量分数=1-混合物中硫元素的质量分数-A元素的质量分数.
解答 解:由于Na和H的相对原子质量和等于Mg的相对原子质量,所以可以从质量角度将“NaH”视为一个与Mg等效的整体A(即将“NaH”和Mg都换用“A”来表示,其相对原子质量可作24),
混合物就相当于是由AS、ASO4、ASO3组成,而此时的混合物中A、S原子个数比为1:1,二者的质量比为24:32=3:4,由于w(S)=a%,故w(A)=$\frac{3}{4}$×a=0.75a%,
氧元素的质量分数=1-a%-0.75a%=1-1.75a%.
故选:C.
点评 本题考查质量分数的有关计算,根据物质组成元素的特点,利用数学的技巧进行换元计算,是解决此类问题所需要的能力,难度中等.

练习册系列答案
相关题目
17.为验证氧化性:Cl2>Fe3+>SO2,某小组用图所示装置进行实验(夹持仪器和A中的加热装置已略,气密性已经检验完毕)实验过程如图:
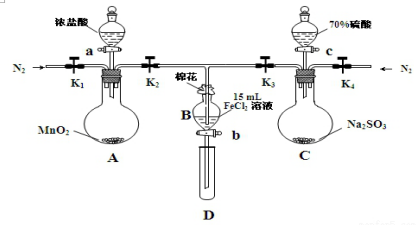
Ⅰ.打开弹簧夹K1~K4,通入一段时间N2,再将T型导管插入B中,继续通入N2,然后关闭K1、K3、K4.
Ⅱ.打开活塞a,滴加一定量的浓盐酸,给A加热.
Ⅲ.当B中溶液变黄时,停止加热,夹紧弹簧夹K2.
Ⅳ.打开活塞b,使约2mL的溶液流入D试管中,检验其中的阳离子.
Ⅴ.打开弹簧夹K3、活塞c,加入70%的硫酸,一段时间后夹紧弹簧夹K3.
Ⅵ.更新试管D,重复过程Ⅳ,检验B溶液中的离子.
(1)过程Ⅰ的目的是排出装置中的氧气.
(2)棉花中浸润的溶液为氢氧化钠溶液.作用是吸收Cl2、SO2,防止污染空气
(3)A中发生反应的化学方程式MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
(4)导致步骤Ⅲ中溶液变黄的离子反应是2Fe2+Cl2═2Fe3++2Cl-.用KSCN(写试剂化学式)检验氧化产物,现象是溶液变红.
(5)能说明氧化性Fe3+>SO2的离子方程式是2Fe3++SO2+2H2O=2Fe2++SO42-+4H+.
(6)甲、乙、丙三位同学分别完成了上述实验,他们的检测结果一定能够证明氧化性Cl2>Fe3+>SO2的是乙丙(填“甲”“乙”“丙”).

Ⅰ.打开弹簧夹K1~K4,通入一段时间N2,再将T型导管插入B中,继续通入N2,然后关闭K1、K3、K4.
Ⅱ.打开活塞a,滴加一定量的浓盐酸,给A加热.
Ⅲ.当B中溶液变黄时,停止加热,夹紧弹簧夹K2.
Ⅳ.打开活塞b,使约2mL的溶液流入D试管中,检验其中的阳离子.
Ⅴ.打开弹簧夹K3、活塞c,加入70%的硫酸,一段时间后夹紧弹簧夹K3.
Ⅵ.更新试管D,重复过程Ⅳ,检验B溶液中的离子.
(1)过程Ⅰ的目的是排出装置中的氧气.
(2)棉花中浸润的溶液为氢氧化钠溶液.作用是吸收Cl2、SO2,防止污染空气
(3)A中发生反应的化学方程式MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
(4)导致步骤Ⅲ中溶液变黄的离子反应是2Fe2+Cl2═2Fe3++2Cl-.用KSCN(写试剂化学式)检验氧化产物,现象是溶液变红.
(5)能说明氧化性Fe3+>SO2的离子方程式是2Fe3++SO2+2H2O=2Fe2++SO42-+4H+.
(6)甲、乙、丙三位同学分别完成了上述实验,他们的检测结果一定能够证明氧化性Cl2>Fe3+>SO2的是乙丙(填“甲”“乙”“丙”).
| 过程ⅣB溶液中含有的离子 | 过程ⅥB溶液中含有的离子 | |
| 甲 | 有Fe3+无Fe2+ | 有SO42- |
| 乙 | 既有Fe3+又有Fe2+ | 有SO42- |
| 丙 | 有Fe3+无Fe2+ | 有Fe2+ |
14.下列对Na2O和Na2O2的叙述正确的是( )
| A. | 都是白色固体 | B. | 都是强氧化剂 | ||
| C. | 与酸反应的生成物都是盐和水 | D. | 都能与水反应形成强碱溶液 |
11.下列说法中,正确的是( )
| A. | SO2的摩尔质量是64 g | |
| B. | 标准状况下18 g水的体积是22.4 L | |
| C. | 14g N2含有的分子数为0.5NA | |
| D. | 1mol/LMgCl2溶液中含有Cl-的数目为2NA |
18.NaNO2是一种食品添加剂,它与酸性KMnO4溶液可发生反应MnO4-+NO2-+H+→Mn2++NO3-+H2O(未配平).下列叙述中正确的是( )
| A. | 生成1 mol NaNO3需消耗0.4 mol KMnO4 | |
| B. | 反应过程中溶液的酸性增强 | |
| C. | 该反应中NO2-被还原 | |
| D. | H+可以是盐酸 |
6.下列离子方程式正确的是( )
| A. | 硫酸铝溶液与过量Ba(OH)2溶液反应2Al3++3SO42-+3 Ba2++8OH-═3BaSO4↓+2A1O2-+4H2O | |
| B. | 碳酸钠溶液中滴加盐酸至恰好要出现气泡时停止:CO32-+2H+═CO2↑+H2O | |
| C. | 酸性高锰酸钾溶液与H2O2溶液混合:2MnO4-+3H2O2+6H+═2Mn2++6H2O+02↑ | |
| D. | 氯气通入亚硫酸钠溶液中:2Cl2+SO32-+H2O═2Cl-+SO2↑+2HClO |
7.下列溶液一定呈中性的是( )
| A. | c(H+)•c(OH-)=10-14的溶液 | B. | pH=7的溶液 | ||
| C. | c(H+)=c(OH-)的溶液 | D. | 使石蕊溶液呈紫色的溶液 |