题目内容
16.研究氮氧化物反应机理,对于控制汽车尾气、保护环境有重要意义.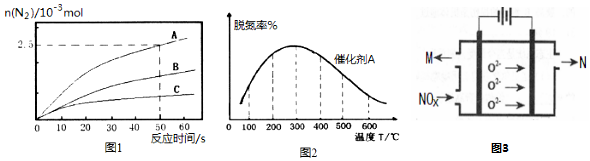
(1)NO在空气中存在如下反应:2NO(g)+O2(g)?2NO2(g)△H上述反应分两步完成,其中第一步反应①如下,写出第二步反应②的热化学方程式(其反应的焓变△H2用含△H、△H1的式子来表示):
①2NO(g)?N2O2(g)△H1<0 ②N2O2(g)+O2(g)?2NO2(g)△H2=△H-△H1
(2)NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术.反应的热化学方程式为:4NH3(g)+6NO(g)═5N2(g)+6H2O(g)△H=-1811.63KJ/mol;反应在恒容密闭容器中进行,在其它相条件同时,选用不同的催化剂,反应产生N2的物质的量随时间变化如图1所示.
①在催化剂A的作用下,经过相同时间,测得脱氮率随反应温度的变化情况如图2所示,据图可知,在相同的时间内,300℃之前,温度升高脱氮率逐渐增大,300℃之后温度升高脱氮率逐渐减小(催化剂均末失效),其可能的原因是300℃前反应未平衡,脱氮率决定于速率,温度越高速率越快,所以脱氮率增大,300℃之后反应达平衡,脱氮率决定于平衡的移动,该反应正反应是放热反应,升高温度平衡逆向移动,脱氮率减小.
②其他条件相同时,请在图2中补充在催化剂B作用下脱氮率随温度变化的曲线.
(3)工业制HNO3的尾气中含有的NO2和NO常用NaOH溶液吸收,反应的化学方程式为:NO+NO2+2NaOH=2NaNO2+H2O,2NO2+2NaOH=NaNO2+NaNO3+H2O,现有平均组成为NOx的NO、NO2混合气体,通入足量的NaOH溶液中,充分反应后没有气体剩余,则:
①x的取值范围为1.5≤x<2.
②反应后溶液中n(NO2-):n(NO3-)=(5-2x):(2x-3).(用含x的代数式表示)
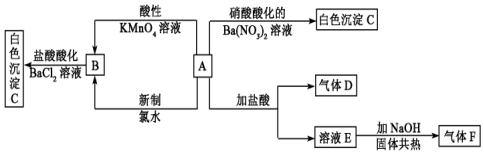
(4)电解法处理氮氧化合物是目前大气污染治理的一个新思路,原理是将NOx在电解池中分解成无污染的N2和O2除去,如图3所示,两电极间是新型固体氧化物陶瓷,在一定条件下可自由传导O2-,电解池阴极反应为2NOx+4xe-=N2+2xO2-.
分析 (1)第二步反应②为:N2O2(g)+O2(g)?2NO2,根据盖斯定律①+②可得:2NO(g)+O2(g)?2NO2(g),总的热化学方程式-①可得②;
(2)由图可知300℃以前温度越高脱氮率越高,300℃后温度越高脱氮率越低,原因可能是300℃前是平衡的建立过程,而300℃后是平衡的移动,故答案为:300℃之前,温度升高脱氮率逐渐增大,300℃之后温度升高脱氮率逐渐减小;300℃前反应未平衡,脱氮率决定于速率,温度越高速率越快,所以脱氮率增大,300℃之后反应达平衡,脱氮率决定于平衡的移动,该反应正反应是放热反应,升高温度平衡逆向移动,脱氮率减小.B催化剂的效率低,所以达平衡的时间长,平衡不移动,但最终的脱氮率不变;
(3)平均组成为NOx的NO、NO2混合气体,通入足量的NaOH溶液中,充分反应后没有气体剩余,根据反应NO+NO2+2NaOH=2NaNO2+H2O和NO2+2NaOH=NaNO2+NaNO3+H2O,说明只有当n(NO2):n(NO)≥1时,混合气体才能被NaOH溶液完全吸收.当n(NO2):n(NO)=1时,x=1.5;当只有NO2时,x=2;故x取值范围为1.5≤x<2.NOx被NaOH溶液完全吸收,根据氧化还原反应中,得失电子守恒规律,计算n(NO2-):n(NO3;
(4)电解法处理氮氧化合物原理是将NOx在电解池中分解成无污染的N2和O2除去,两电极间是固体氧化物电解质,在一定条件下可自由传导O2-,阴极发生还原反应,阴极上是NOx获得电子生成N2与O2-.
解答 解:(1)第二步反应②为:N2O2(g)+O2(g)?2NO2,根据盖斯定律①+②可得:2NO(g)+O2(g)?2NO2(g),总的热化学方程式-①可得②,则反应②的热化学方程式为:N2O2(g)+O2(g)=2NO2(g)△H2=△H-△H1 ,
故答案为:N2O2(g)+O2(g)?2NO2(g)△H2=△H-△H1;
(2)由图可知300℃以前温度越高脱氮率越高,300℃后温度越高脱氮率越低,原因可能是300℃前是平衡的建立过程,而300℃后是平衡的移动,故答案为:300℃之前,温度升高脱氮率逐渐增大,300℃之后温度升高脱氮率逐渐减小;300℃前反应未平衡,脱氮率决定于速率,温度越高速率越快,所以脱氮率增大,300℃之后反应达平衡,脱氮率决定于平衡的移动,该反应正反应是放热反应,升高温度平衡逆向移动,脱氮率减小.B催化剂的效率低,所以达平衡的时间长,平衡不移动,但最终的脱氮率不变,所以图象为 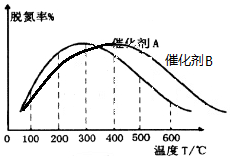 ,
,
故答案为:300℃前反应未平衡,脱氮率决定于速率,温度越高速率越快,所以脱氮率增大,300℃之后反应达平衡,脱氮率决定于平衡的移动,该反应正反应是放热反应,升高温度平衡逆向移动,脱氮率减小; ;
;
(3)平均组成为NOx的NO、NO2混合气体,通入足量的NaOH溶液中,充分反应后没有气体剩余,根据反应NO+NO2+2NaOH=2NaNO2+H2O和NO2+2NaOH=NaNO2+NaNO3+H2O,说明只有当n(NO2):n(NO)≥1时,混合气体才能被NaOH溶液完全吸收.当n(NO2):n(NO)=1时,x=1.5;当只有NO2时,x=2;故x取值范围为1.5≤x<2.NOx被NaOH溶液完全吸收,根据氧化还原反应中,得失电子守恒规律,可写出反应的化学方程式为2NOx+2NaOH=(5-2x)NaNO2+(2x-3)NaNO3+H2O,因此反应后溶液中n(NO2-):n(NO3-)=(5-2x):(2x-3),
故答案为:为1.5≤x<2;(5-2x):(2x-3);
(4)电解法处理氮氧化合物原理是将NOx在电解池中分解成无污染的N2和O2除去,两电极间是固体氧化物电解质,在一定条件下可自由传导O2-,阴极发生还原反应,阴极上是NOx获得电子生成N2与O2-,电极反应式为:2NOx+4xe-=N2+2xO2-,
故答案为:2NOx+4xe-=N2+2xO2-.
点评 本题考查了盖斯定律,化学平衡的影响因素,化学反应速率的影响因素,氮的化合物,氧化还原反应,电解原理的应用,注意基础知识的积累,题目难度中等.

| A. | “海水淡化”可以解决淡水供应危机,向海水中加入明矾可以使海水淡化 | |
| B. | 漂白粉解决了氯水漂白时不稳定、难以保存、使用不方便、效果不理想的问题 | |
| C. | 钢铁的腐蚀最普遍的是吸氧腐蚀,最终产物为铁锈 | |
| D. | 温度、压强一定时,放热且熵增的反应能自发进行 |
| A. | 使用含有氯化钙的融雪剂会加速桥梁的腐蚀 | |
| B. | 近期出现在北方的雾霾是一种分散系,带活性炭口罩的原理是吸附作用 | |
| C. | 我国部分城市在推广使用的“甲醇汽油”有降低排放废气的优点,无任何负面作用 | |
| D. | 亚硝酸钠易致癌,但火腿肠中允许含少量的亚硝酸钠以保持肉质新鲜 |
| A. | a>b>2c | B. | a=b<2c | C. | b=2c=a | D. | b=2c<a |
| A. | 1mol氯气参加氧化还原反应时电子转移数一定是2NA | |
| B. | 常温常压下,56 g Fe与足量的盐酸完全反应转移的电子数为3NA | |
| C. | 同温同压下,等质量的H2和O2的体积之比是16:1 | |
| D. | 1mol的Na2O2固体中含有离子数为4NA |
| A. | 1.75a% | B. | 1.25a% | C. | 1-1.75a% | D. | 1-1.25a% |
 2,3,4-三甲基己烷,C9H20
2,3,4-三甲基己烷,C9H20 3-甲基-3,4-二乙基庚烷,C12H26.
3-甲基-3,4-二乙基庚烷,C12H26.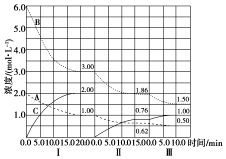 已知某放热热反应在1L的密闭容器中进行反应.保持容器体积不变,改变其他反应条件,在Ⅰ、Ⅱ、Ⅲ阶段体系中各气体物质浓度随时间变化的曲线如图所示:
已知某放热热反应在1L的密闭容器中进行反应.保持容器体积不变,改变其他反应条件,在Ⅰ、Ⅱ、Ⅲ阶段体系中各气体物质浓度随时间变化的曲线如图所示: