题目内容
17.为验证氧化性:Cl2>Fe3+>SO2,某小组用图所示装置进行实验(夹持仪器和A中的加热装置已略,气密性已经检验完毕)实验过程如图: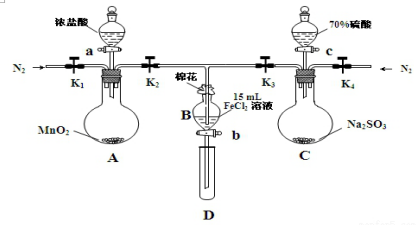
Ⅰ.打开弹簧夹K1~K4,通入一段时间N2,再将T型导管插入B中,继续通入N2,然后关闭K1、K3、K4.
Ⅱ.打开活塞a,滴加一定量的浓盐酸,给A加热.
Ⅲ.当B中溶液变黄时,停止加热,夹紧弹簧夹K2.
Ⅳ.打开活塞b,使约2mL的溶液流入D试管中,检验其中的阳离子.
Ⅴ.打开弹簧夹K3、活塞c,加入70%的硫酸,一段时间后夹紧弹簧夹K3.
Ⅵ.更新试管D,重复过程Ⅳ,检验B溶液中的离子.
(1)过程Ⅰ的目的是排出装置中的氧气.
(2)棉花中浸润的溶液为氢氧化钠溶液.作用是吸收Cl2、SO2,防止污染空气
(3)A中发生反应的化学方程式MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
(4)导致步骤Ⅲ中溶液变黄的离子反应是2Fe2+Cl2═2Fe3++2Cl-.用KSCN(写试剂化学式)检验氧化产物,现象是溶液变红.
(5)能说明氧化性Fe3+>SO2的离子方程式是2Fe3++SO2+2H2O=2Fe2++SO42-+4H+.
(6)甲、乙、丙三位同学分别完成了上述实验,他们的检测结果一定能够证明氧化性Cl2>Fe3+>SO2的是乙丙(填“甲”“乙”“丙”).
| 过程ⅣB溶液中含有的离子 | 过程ⅥB溶液中含有的离子 | |
| 甲 | 有Fe3+无Fe2+ | 有SO42- |
| 乙 | 既有Fe3+又有Fe2+ | 有SO42- |
| 丙 | 有Fe3+无Fe2+ | 有Fe2+ |
分析 A装置为制取氯气的装置,B装置为氯气氧化亚铁离子的装置,B中盛放氯化亚铁溶液,C装置制备二氧化硫.
(1)装置中存在氧气,会氧化亚铁离子,在溶液中可以氧化二氧化碳;
(2)Cl2、SO2有毒污染空气,应有尾气处理;
(3)浓盐酸与二氧化锰再加热条件下反应生成氯化锰、氯气与水;
(4)当B中溶液变黄时即氯气将二价铁氧化成三价铁离子,用KSCN溶液检验;
(5)根据氧化还原反应中氧化剂的氧化性强于还原剂的氧化性结合三价铁离子氧化二氧化硫生成二价铁和硫酸根书写离子方程式;
(6)氧化还原反应中氧化剂的氧化性强于氧化产物,也强于还原剂的氧化性;
甲.B可能有存在溶解的氯气氧化SO2;
乙.B中存在Fe3+、Fe2+,说明Cl2氧化性强于Fe3+,且没有Cl2剩余,后有SO42-能说明Fe3+氧化性强于SO2;丙.B中存在Fe3+,说明Cl2氧化性强于Fe3+,后生成了Fe2+,只能是Fe3+被SO2还原.
解答 解:(1)装置中存在氧气,会对实验结果产生影响,故先排尽装置中的空气,
故答案为:排出装置中的氧气;
(2)Cl2、SO2有毒污染空气,应有尾气处理,装置中的棉花需要浸润强碱溶液吸收Cl2、SO2,防止污染空气;
故答案为:氢氧化钠溶液;吸收Cl2、SO2,防止污染空气;
(3)A中发生反应为制备氯气,反应方程式为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,
故答案为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
(4)当B中溶液变黄时即氯气将二价铁氧化成三价铁离子,离子方程式为:2Fe2+Cl2═2Fe3++2Cl-,用KSCN溶液检验三价铁离子,现象是溶液变红;
故答案为:2Fe2+Cl2═2Fe3++2Cl-;KSCN;溶液变红;
(5)根据氧化还原反应中氧化剂的氧化性强于还原剂的氧化性,则能说明氧化性Fe3+>SO2的离子方程式是三价铁离子氧化二氧化硫生成二价铁和硫酸根,则离子方程式为:2Fe3++SO2+2H2O=2Fe2++SO42-+4H+,故答案为:2Fe3++SO2+2H2O=2Fe2++SO42-+4H+;
(6)理论依据是氧化还原反应中氧化剂的氧化性强于氧化产物,也强于还原剂的氧化性;
甲.B可能有存在溶解的氯气氧化SO2,故错误;
乙.B中存在Fe3+、Fe2+,说明Cl2氧化性强于Fe3+,且没有Cl2剩余,故后有SO42-能说明Fe3+氧化性强于SO2,故正确;
丙.B中存在Fe3+,说明Cl2氧化性强于Fe3+,后生成了Fe2+,只能是Fe3+被SO2还原,故正确;
故选:乙丙.
点评 本题是综合化学实验题,考查实验的具体操作步骤、操作目的、原理、微粒的检验及分析等有关问题,有利于培养学生的分析推理、思维缜密等,是对学生综合能力的考查,难度较大.

| A. | a>b>2c | B. | a=b<2c | C. | b=2c=a | D. | b=2c<a |
| A. | 1mol氯气参加氧化还原反应时电子转移数一定是2NA | |
| B. | 常温常压下,56 g Fe与足量的盐酸完全反应转移的电子数为3NA | |
| C. | 同温同压下,等质量的H2和O2的体积之比是16:1 | |
| D. | 1mol的Na2O2固体中含有离子数为4NA |
| A. | 小苏打溶液与少量澄清石灰水混合:Ca2++OH-+HCO3-═CaCO3↓+H2O | |
| B. | AlCl3溶液中加入足量的氨水:Al3++4OH-═AlO2-+2H2O | |
| C. | 将氯气通入水中:Cl2+H2O=Cl-+ClO-+2H+ | |
| D. | 向Fe(NO3)2溶液中加入稀盐酸:3Fe2++4H++NO3-═3Fe3++NO↑+2H2O |
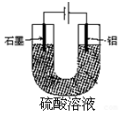 铝阳极氧化处理后形成的氧化膜比铝的天然氧化膜耐磨性、耐腐蚀性及装饰性有明显的提高,工业中以铝为阳极,置于硫酸溶液中电解,装置如图,下列说法正确的是( )
铝阳极氧化处理后形成的氧化膜比铝的天然氧化膜耐磨性、耐腐蚀性及装饰性有明显的提高,工业中以铝为阳极,置于硫酸溶液中电解,装置如图,下列说法正确的是( )| A. | 阳极电极方程式为Al-3e+6OH-=Al2O3+3H2O | |
| B. | 随着电解的进行,溶液的pH逐渐增大 | |
| C. | 当阴极生成气体3.36L(标况)时,阳极增重2.4g | |
| D. | 电解过程中H+移向Al电极 |
| A. | 氧化剂在反应中失去电子,还原剂在反应中得到电子 | |
| B. | 金属在反应中只能作还原剂,非金属在反应中只能作氧化剂 | |
| C. | 阳离子只有氧化性,阴离子只有还原性 | |
| D. | 氧化剂具有氧化性,还原剂具有还原性 |
| A. | 1.75a% | B. | 1.25a% | C. | 1-1.75a% | D. | 1-1.25a% |
| 选项 | 实验操作 | 实验目的或结论 |
| A | 往某溶液中加入BaCl2溶液产生白色沉淀 | 该溶液含有SO42- |
| B | 将氯气分别通入KI溶液和NaBr溶液中 | 证明还原性的强弱:I->Br->Cl- |
| C | 由Fe-Cu做电极,浓硝酸做电解质溶液组成的原电池 | 证明金属活泼性Fe>Cu |
| D | C2H5OH与浓硫酸170℃共热,制得的气体先通过足量的NaOH溶液,再通入酸性KMnO4溶液 | 使KMnO4溶液褪色的气体是乙烯 |
| A. | A | B. | B | C. | C | D. | D |
 2,3,4-三甲基己烷,C9H20
2,3,4-三甲基己烷,C9H20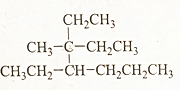 3-甲基-3,4-二乙基庚烷,C12H26.
3-甲基-3,4-二乙基庚烷,C12H26.