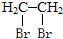题目内容
4.某元素Z的核外电子数等于核内中子数,取其单质2.8g 与O2完全反应,可得6g化合物ZO2,Z 元素在周期表中位置是( )①第3周期 ②第2周期 ③第ⅣA 族 ④第ⅤA族.
| A. | ②④ | B. | ①④ | C. | ①③ | D. | ②③ |
分析 利用质量守恒定律计算参加反应氧气质量,再根据化学式中R、O元素质量之比计算R的相对分子质量,进而计算R的质子数确定元素.
解答 解:2.8gR元素单质与氧气完全反应,可得到6g化合物RO2,则氧元素质量=6g-2.8g=3.2g,令R的相对原子质量为a,则$\frac{a}{32}$=$\frac{2.8g}{3.2g}$,解得a=28,元素R的核外电子数等于核内中子数,故R的质子数为14,故为Si元素,在周期表中位于第3周期第IVA族;
故选C.
点评 本题考查了元素的推断和周期表的结构,题目难度不大,明确化合物化学式RO2中R元素与O元素的关系是解本题的关键,侧重于考查学生的分析能力和计算能力.

练习册系列答案
相关题目
15.短周期主族元素X、Y、Z、W原子序数依次增大,X最外层电子数是次外层2倍,Y是非金属性最强的元素,Z原子半径在同周期元素中最大,W可与Z形成离子化合物Z2W.下列说法正确的是( )
| A. | 四种元素在自然界均不能以游离态存在 | |
| B. | X、Z、W均可形成两种常见氧化物 | |
| C. | 元素X、Y、W的最高化合价均与其族序数相等 | |
| D. | 离子半径:W>Z>Y |
12.下列有关元素周期表的说法错误的是( )
| A. | 可在金属与非金属交界处寻找半导体材料 | |
| B. | 农药中常含有的元素通常在元素周期表的右上方区域内 | |
| C. | 作催化剂材料的元素通常在元素周期表的左下方区域内 | |
| D. | 在过渡元素中可寻找耐高温和耐腐蚀的合金材料 |
19.与氢氧根具有相同的质子数和电子数的微粒是( )
| A. | CH4 | B. | NH4 + | C. | NH2- | D. | Cl- |
16.短周期元素A、B、C、D在周期表中的位置关系如图所示.已知在同周期元素的常见简单离子中,D的离子半径最小,E是周期表中半径最小的原子
回答下列问题:
(1)C元素在元素周期表中的位置是第二周期第VIA 族.元素D的离子结构示意图为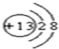
(2)B、E两元素按原子数目比1:3和2:4构成分子X和Y,X的电子式为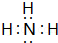 ,Y的结构式为
,Y的结构式为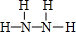
(3)工业上冶炼单质D的化学反应方程式2Al2O3(熔融)$\frac{\underline{\;\;\;电解\;\;\;}}{冰晶石}$4Al+3O2↑.
(4)超细DB粉末被应用于大规模集成电路领域.其制作原理为D2C3、B2、A在高温下反应生成两种化合物,这两种化合物均由两种元素组成,且原子个数比均为1:l;其反应的化学方程式为Al2O3+N2+3C $\frac{\underline{\;高温\;}}{\;}$ 2AlN+3CO.
| A | B | C | |
| D |
(1)C元素在元素周期表中的位置是第二周期第VIA 族.元素D的离子结构示意图为

(2)B、E两元素按原子数目比1:3和2:4构成分子X和Y,X的电子式为
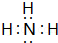 ,Y的结构式为
,Y的结构式为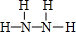
(3)工业上冶炼单质D的化学反应方程式2Al2O3(熔融)$\frac{\underline{\;\;\;电解\;\;\;}}{冰晶石}$4Al+3O2↑.
(4)超细DB粉末被应用于大规模集成电路领域.其制作原理为D2C3、B2、A在高温下反应生成两种化合物,这两种化合物均由两种元素组成,且原子个数比均为1:l;其反应的化学方程式为Al2O3+N2+3C $\frac{\underline{\;高温\;}}{\;}$ 2AlN+3CO.
14.下列热化学方程式中,△H能正确表示物质的燃烧热的是( )
| A. | 2CO(g)+O2(g)═2CO2(g)△H=-566.0 kJ/mol | |
| B. | C(s)+$\frac{1}{2}$O2(g)═CO(g)△H=-110.5 kJ/mol | |
| C. | CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.31 kJ/mol | |
| D. | 2C8H18(l)+25O2(g)═16CO2(g)+18H2O(l)△H=-11036 kJ/mol |

 、C
、C .
. $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$ +2H2O.
+2H2O. B.
B.
 D.
D.
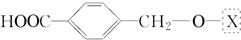 ,为了研究X的结构,将化合物A在一定条件下水解只得到B(分子式为C8H8O3)和C(分子式为C7H6O3).C遇FeCl3水溶液显紫色,与NaHCO3溶液反应有CO2产生.
,为了研究X的结构,将化合物A在一定条件下水解只得到B(分子式为C8H8O3)和C(分子式为C7H6O3).C遇FeCl3水溶液显紫色,与NaHCO3溶液反应有CO2产生.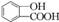 .
. 任意2种.
任意2种.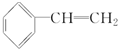 为主要原料制备
为主要原料制备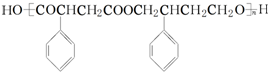 的合成路线流程图(无机试剂任选).
的合成路线流程图(无机试剂任选).