题目内容
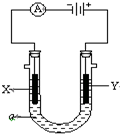
10.在25℃时,用石墨电极电解1.0L,2.5mol/LCuSO4溶液.5min后,在一个石墨电极上有3.2g Cu生成.试回答下列问题:(1)阳极发生氧化反应,电极反应式为4OH--4e-═2H2O+O2↑.
(2)有0.1mol电子发生转移,得到O2的体积(标准状况)是560mL
(3)如用等质量的两块铜片代替石墨作电极,电解相同时间后两铜片的质量相差6.4g.
分析 溶液中n(CuSO4)=2.5mol/L×1.0L=2.5mol,根据Cu原子守恒得溶液中n(Cu2+)=n(CuSO4)=2.5mol,析出n(Cu)=$\frac{3.2g}{64g/mol}$=0.05mol<2.5mol,则还有部分硫酸铜没有电解;
(1)电解时,阴极上得电子发生还原反应,阳极上OH-失电子发生氧化反应;
(2)根据Cu和转移电子之间的关系、转移电子守恒计算转移电子物质的量及氧气体积;
(3)若用Cu作电极材料,则阳极上Cu失电子、阴极上Cu2+得电子,根据转移电子相等知,阳极上溶解的Cu等于阴极上析出的Cu,电解相同时间后两铜片的质量相差等溶解Cu的质量和析出Cu的质量之和.
解答 解:溶液中n(CuSO4)=2.5mol/L×1.0L=2.5mol,根据Cu原子守恒得溶液中n(Cu2+)=n(CuSO4)=2.5mol,析出n(Cu)=$\frac{3.2g}{64g/mol}$=0.05mol<2.5mol,则还有部分硫酸铜没有电解;
(1)电解时,阴极上得电子发生还原反应,阳极上OH-失电子发生氧化反应,阳极反应式为4OH--4e-═2H2O+O2↑,故答案为:阳;4OH--4e-═2H2O+O2↑;
(2)阴极反应为Cu2++2e-=Cu,转移电子物质的量=2(Cu2+)=0.05mol×2=0.1mol,根据转移电子守恒得析出氧气体积=$\frac{0.05mol×2}{4}$×22.4L/mol=560mL,故答案为:0.1;560;
(3)若用Cu作电极材料,则阳极上Cu失电子、阴极上Cu2+得电子,根据转移电子相等知,阳极上溶解的Cu等于阴极上析出的Cu,电解相同时间后两铜片的质量相差等溶解Cu的质量和析出Cu的质量之和=3.2g×2=6.4g,
故答案为:6.4.
点评 本题考查电解原理,为高频考点,侧重考查分析计算能力,明确各个电极上发生的反应及各个物理量之间的关系是解本题关键,易错点是(3)题计算,题目难度中等.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 0.2 mol | B. | 0.1 mol | C. | 0.2 mol/L | D. | 0.1 mol/L |
| A. | 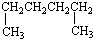 1,4-二甲基丁烷 1,4-二甲基丁烷 | B. | 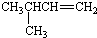 3-甲基丁烯 3-甲基丁烯 | ||
| C. | 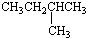 2-甲基丁烷 2-甲基丁烷 | D. | CH2Cl-CH2Cl 二氯乙烷 |
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | H | |||||||
| 2 | C | O | ||||||
| 3 | Na | Mg | Al | Si | S | |||
(2)S元素的最高正化合价是+6.
(3)Na、Mg、Al三种元素的金属性逐渐减弱(填“减弱”或“增强”).
(4)某元素位于元素周期表中第3周期第ⅦA族,该元素的原子结构示意图是c(选填编号).
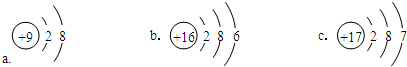
| A. | 四种元素在自然界均不能以游离态存在 | |
| B. | X、Z、W均可形成两种常见氧化物 | |
| C. | 元素X、Y、W的最高化合价均与其族序数相等 | |
| D. | 离子半径:W>Z>Y |
| A. | CH4 | B. | NH4 + | C. | NH2- | D. | Cl- |
| A. | 硝基苯 | B. | 溴苯 | C. | 四氯化碳 | D. | 氯乙烯 |
 电解原理在化学工业中有广泛应用.
电解原理在化学工业中有广泛应用.