题目内容
17.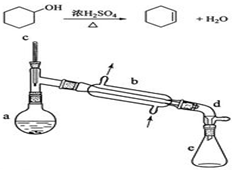 醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如下:
醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如下:可能用到的有关数据如表:
| 相对分子质量 | 密度/(g•cm-3) | 沸点/℃ | 溶解性 | |
| 环已醇 | 100 | 0.9618 | 161 | 微溶于水 |
| 环已烯 | 82 | 0.8102 | 83 | 难溶于水 |
在a中加入20g环己醇和2小片碎瓷片,冷却搅动下慢慢加入1mL浓硫酸.B中通入冷却水后,开始缓慢加热a,控制馏出物的温度不超过90℃.
分离提纯:
反应粗产物倒入分液漏斗中分别用少量5%碳酸钠溶液和水洗涤,分离后加入无水氯化钙颗粒,静置一段时间后弃去氯化钙.最终通过蒸馏得到纯净环己烯10g.
回答下列问题:
(1)装置b的名称是直形冷凝器.
(2)加入碎瓷片的作用是防止暴沸;如果加热一段时间后发现忘记加碎瓷片,应该采取的正确操作时B(填正确答案标号).
A.立即补加 B.冷却后补加 C.不需补加 D.重新配料
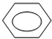
(3)本实验中最容易产生的副产物的结构简式为
 .
.(4)分液漏斗在使用前须清洗干净并检查是否漏液;在本实验分离过程中,产物应该从分液漏斗的上口倒出(填“上口倒出”或“下口放出”).
(5)分离提纯过程中加入无水氯化钙的目的是干燥.
(6)在环己烯粗产物蒸馏过程中,不可能用到的仪器有CD(填正确答案标号).
A.蒸馏烧瓶 B.温度计 C.吸滤瓶 D.球形冷凝管 E.接收器
(7)本实验所得到的环己烯产率是c(填正确答案标号).
A.41% B.50% C.61% D.70%
分析 (1)根据装置图可知装置b的名称;
(2)碎瓷片的存在可以防止在加热过程中产生暴沸现象,补加碎瓷片时需要待已加热的试液冷却后再加入;
(3)加热过程中,环己醇除可发生消去反应生成环己烯外,还可以发生取代反应生成二环己醚;
(4)由于分液漏斗有活塞开关,故使用前需要检查是否漏液;分液过程中,由于环己烯的密度比水的密度小,故应该从分液漏斗的上口倒出;
(5)无水氯化钙用于吸收产物中少量的水;
(6)观察题目提供的实验装置图知蒸馏过程中不可能用到吸滤瓶和球形冷凝器管;
(7)环己醇为0.2mol,根据反应方程式,理论上可以得到0.2mol环己烯,其质量为16.4g,根据产率=$\frac{实际产量}{理论产量}$×100%计算.
解答 解:(1)依据装置图分析可知装置b是蒸馏装置中的冷凝器装置,
故答案为:直形冷凝器;
(2)碎瓷片的存在可以防止在加热过程中产生暴沸现象,补加碎瓷片时需要待已加热的试液冷却后再加入,故选B,
故答案为:防止暴沸;B;
(3)加热过程中,环己醇除可发生消去反应生成环己烯外,还可以发生取代反应,分子间发生脱水反应生成二环己醚为 ,
,
故答案为: ;
;
(4)由于分液漏斗有活塞开关,故使用前需要检查是否漏液;分液过程中,由于环己烯的密度比水的密度小,故应该从分液漏斗的上口倒出,
故答案为:检查是否漏液;上口倒出;
(5)分离提纯过程中加入无水氯化钙的目的是利用无水氯化钙吸收产物中少量的水,
故答案为:干燥;
(6)观察题目提供的实验装置图知蒸馏过程中不可能用到吸滤瓶和球形冷凝器管,
故选:CD;
(7)环己醇为0.2mol,理论上可以得到0.2mol环己烯,其质量为16.4g,所以产率=$\frac{10g}{16.4g}$×100%=61%,
故选C.
点评 本题考查了物质制备实验方案设计,醇性质的分析应用,实验现象和原理的分析判断,掌握基础是解题关键,题目难度中等.

| A. | MgCl2 | B. | NaOH | C. | O2 | D. | C6H6 |
 +HO-NO2→
+HO-NO2→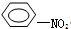 +H2O.
+H2O.


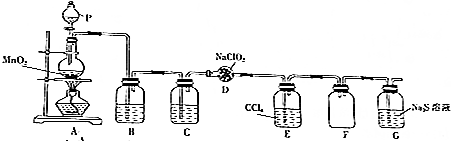
 ClO2作为一种广谱型的消毒剂,其有效氯是氯气的2.6倍.如图是实验室用于制备ClO2并检验其部分性质的装置(某些夹持装置省略).
ClO2作为一种广谱型的消毒剂,其有效氯是氯气的2.6倍.如图是实验室用于制备ClO2并检验其部分性质的装置(某些夹持装置省略).