题目内容
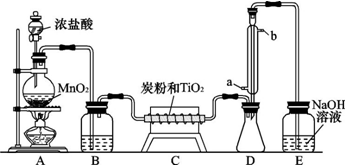
12.多晶硅(硅单质的一种)被称为“微电子大厦的基石”,制备中副产物以SiCl4为主,它对环境污染很大,能遇水强烈水解,放出大量的热.研究人员利用SiCl4水解生成的盐酸和钡矿粉(主要成份为BaCO3,且含有少量钙、铁、镁离子)制备BaCl2•2H2O,工艺流程如图.
已知25℃时,Fe3+、Ca2+、Mg2+完全沉淀的pH分别是:3.4、13.1、12.4
(1)已知:SiCl4(s)+H2(g)═SiHCl3(s)+HCl(g)△H1=47kJ•mol-1
SiHCl3(s)+H2(g)═Si(s)+3HCl(g)△H2=189kJ•mol-1
则由SiCl4制备硅的热化学方程式为SiCl4(s)+2H2(g)=Si(s)+4HCl(g)△H=+236kJ•mol-1.
(2)加钡矿粉时生成BaCl2的离子反应方程式是BaCO3+2H+=Ba2++CO2↑+H2O.
(3)加20% NaOH调节pH=12.5,得到滤渣A的主要成分是Mg(OH)2、Ca(OH)2,控制温度70℃的目的是让钙离子沉淀完全.
(4)BaCl2滤液经蒸发浓缩、降温结晶、过滤,再经真空干燥后得到BaCl2•2H2O.实验室中蒸发浓缩用到的含硅酸盐的仪器有三种.
分析 流程分析可知四氯化硅控制温度40°C,加入水水解生成原硅酸和氯化氢,过滤得到盐酸溶液,加入钡矿粉主要成分为BaCO3,且含有铁、镁等离子,调节溶液pH=7,使BaCO3转化为BaCl2,同时使Fe3+完全沉淀,过滤得到滤渣为氢氧化铁,滤液加入氢氧化钠溶液调节溶液pH=12.5,控制70°C,得到氢氧化镁沉淀,过滤得到滤液为氯化钡溶液蒸发浓缩,冷却结晶,过滤洗涤得到氯化钡晶体;
(1)已知:①SiCl4(s)+H2(g)═SiHCl3(s)+HCl(g)△H1=47kJ•mol-1
②SiHCl3(s)+H2(g)═Si(s)+3HCl(g)△H2=189kJ•mol-1
根据盖斯定律,①+②可得;
(2)碳酸钡与盐酸反应生成氯化钡、二氧化碳与水;
(3)滤渣A的主要成分是氢氧化镁、氢氧化钙;温度越高,Ca(OH)2溶解度越小;
(4)蒸发浓缩用到的含硅酸盐的仪器有:蒸发皿、酒精灯、玻璃棒.
解答 解:(1)已知:①SiCl4(s)+H2(g)═SiHCl3(s)+HCl(g)△H1=47kJ•mol-1
②SiHCl3(s)+H2(g)═Si(s)+3HCl(g)△H2=189kJ•mol-1
由盖斯定律,①+②可得:SiCl4(s)+2H2(g)=Si(s)+4HCl(g)△H=+236 kJ•mol-1,
故答案为:SiCl4(s)+2H2(g)=Si(s)+4HCl(g)△H=+236 kJ•mol-1;
(2)碳酸钡与盐酸反应生成氯化钡、二氧化碳与水,反应离子方程式为:BaCO3+2H+=Ba2++CO2↑+H2O,
故答案为:BaCO3+2H+=Ba2++CO2↑+H2O;
(3)滤渣A的主要成分是Mg(OH)2、Ca(OH)2;温度越高,Ca(OH)2溶解度越小,控制温度70℃让钙离子沉淀完全,
故答案为:Mg(OH)2、Ca(OH)2;让钙离子沉淀完全;
(4)蒸发浓缩用到的含硅酸盐的仪器有:蒸发皿、酒精灯、玻璃棒,
故答案为:三.
点评 本题考查物质制备工艺流程,涉及物质的分离提纯、对操作与条件控制分析、热化学方程式书写等,关键是对工艺流程的理解,是对化学实验的综合考查,充分考查了学生的分析理解能力及知识迁移运用的能力,难度中等.

 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案| A. | 20g | B. | 20g•mol-1 | C. | 40mol•g-1 | D. | 40g•mol-1 L |
(1)乙醇是重要的化工产品和液体燃料,可以利用下列反应制取乙醇.
2CO2(g)+6H2(g)?CH3CH2OH(g)+3H2O(g)△H=a kJ/mol
在一定压强下,测得上述反应的实验数据如表.
| 温度/K CO2转化率% $\frac{n({H}_{2})}{n(C{O}_{2})}$ | 500 | 600 | 700 | 800 |
| 1.5 | 45% | 33% | 20% | 12% |
| 2.0 | 60% | 43% | 28% | 15% |
| 3.0 | 83% | 62% | 37% | 22% |
①上述反应的a小于0(填“大于”或“小于”).
②在一定温度下,提高氢碳(即$\frac{n({H}_{2})}{n(C{O}_{2})}$)比,平衡常数K值不变(填“增大”、“减小”、或“不变”).
(2)催化剂存在的条件下,在固定容积的密闭容器中投入一定量的CO和H2,同样可制得乙醇(可逆反应).该反应过程中能量变化如图所示:
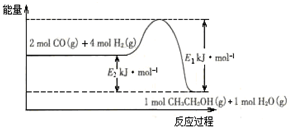
在一定温度下,向上述密闭容器中加入1mol CO、3mol H2及固体催化剂,使之反应.平衡时,反应产生的热量为Q kJ,若温度不变的条件下,向上述密闭容器中加入4mol CO、12mol H2及固体催化剂,平衡时,反应产生的热量为w kJ,则w的范围为4Q<w<2 (E2-E1).
(3)以乙醇蒸气、空气、氢氧化钠溶液为原料,石墨为电极可构成燃料电池,其工作原理与甲烷燃料电池原理相类似.该电池中负极上的电极反应式是CH3CH2OH-12e-+16OH-=2CO32-+11H2O.使用上述乙醇燃料电池电解(Pt电极)一定浓度的硫酸铜溶液通电一段时间后,向所得的溶液中加入0.1mol Cu(OH)2后恰好恢复到电解前的浓度和pH,则乙醇燃料电池在电解过程中转移电子数是0.4NA.
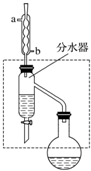 乙酸丁酯是重要的化工原料,具有水果香味.实验室制备乙酸丁酯的反应、装置示意图和有关信息如下:
乙酸丁酯是重要的化工原料,具有水果香味.实验室制备乙酸丁酯的反应、装置示意图和有关信息如下:CH3COOH+CH3CH2CH2CH2OH$?_{浓H_{2}SO_{4}}^{△}$ CH3COOCH2CH2CH2CH3+H2O
| 乙酸 | 正丁醇 | 乙酸丁酯 | |
| 熔点/℃ | 16.6 | -89.5 | -73.5 |
| 沸点/℃ | 117.9 | 117 | 126.0 |
| 密度/g•cm-3 | 1.1 | 0.80 | 0.88 |
在干燥的50mL圆底烧瓶中,装入沸石,加入12.0mL正丁醇和16.0mL冰醋酸(过量),再加3~4滴浓硫酸.然后再安装分水器(作用:实验过程中不断分离除去反应生成的水)、冷凝管,然后小火加热.将烧瓶中反应后的混合物冷却与分水器的酯层合并.装置中冷水应从b(填“a”或“b”)口通入;通过分水器不断分离除去反应生成的水的目的是分离生成的水,使平衡正向移动,提高反应产率.
(2)乙酸丁酯的精制
将乙酸丁酯粗产品用如下的操作进行精制:①水洗、②蒸馏、③用无水MgSO4干燥、④用10%碳酸钠洗涤.
①正确的操作步骤是c(填标号).
A.①②③④B.③①④②C.④①③②D.③④①②
②在乙酸丁酯的精制中,用10%碳酸钠洗涤的主要目的是除去产品中含有的乙酸、硫酸等杂质.
③在洗涤、分液操作中,应充分振荡,然后静置,待分层后d(填标号).
a.直接将乙酸丁酯从分液漏斗的上口倒出
b.直接将乙酸丁酯从分液漏斗的下口放出
c.先将水层从分液漏斗的下口放出,再将乙酸丁酯从下口放出
d.先将水层从分液漏斗的下口放出,再将乙酸丁酯从上口倒出
(3)计算产率
测量分水器内由乙酸与丁醇反应生成的水体积为1.8mL,假设在制取乙酸丁酯过程中反应物和生成物没有损失,且忽略副反应,乙酸丁酯的产率为77.1%.
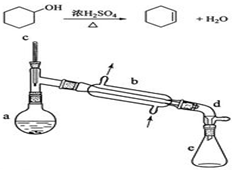 醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如下:
醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如下:可能用到的有关数据如表:
| 相对分子质量 | 密度/(g•cm-3) | 沸点/℃ | 溶解性 | |
| 环已醇 | 100 | 0.9618 | 161 | 微溶于水 |
| 环已烯 | 82 | 0.8102 | 83 | 难溶于水 |
在a中加入20g环己醇和2小片碎瓷片,冷却搅动下慢慢加入1mL浓硫酸.B中通入冷却水后,开始缓慢加热a,控制馏出物的温度不超过90℃.
分离提纯:
反应粗产物倒入分液漏斗中分别用少量5%碳酸钠溶液和水洗涤,分离后加入无水氯化钙颗粒,静置一段时间后弃去氯化钙.最终通过蒸馏得到纯净环己烯10g.
回答下列问题:
(1)装置b的名称是直形冷凝器.
(2)加入碎瓷片的作用是防止暴沸;如果加热一段时间后发现忘记加碎瓷片,应该采取的正确操作时B(填正确答案标号).
A.立即补加 B.冷却后补加 C.不需补加 D.重新配料
(3)本实验中最容易产生的副产物的结构简式为
 .
.(4)分液漏斗在使用前须清洗干净并检查是否漏液;在本实验分离过程中,产物应该从分液漏斗的上口倒出(填“上口倒出”或“下口放出”).
(5)分离提纯过程中加入无水氯化钙的目的是干燥.
(6)在环己烯粗产物蒸馏过程中,不可能用到的仪器有CD(填正确答案标号).
A.蒸馏烧瓶 B.温度计 C.吸滤瓶 D.球形冷凝管 E.接收器
(7)本实验所得到的环己烯产率是c(填正确答案标号).
A.41% B.50% C.61% D.70%
| A. | 向水中加入少量固体硫酸氢钠,c(H+)增大,Kw不变 | |
| B. | 向水中加入氨水,平衡逆向移动,c(OH-)降低 | |
| C. | 向水中加入金属钠,平衡正向移动,c(H+)增大 | |
| D. | 将水加热,KW增大,pH不变 |