题目内容
已知化学反应与数据关系如下表:
请回答下列问题:
(1)反应②是 (填“吸热”或“放热”)反应.
(2)写出反应①的平衡常数K1的表达式 .
(3)根据反应①与②可推导出K1、K2与K3之间的关系,则K3= (用K1、K2表示).
(4)要使反应③在一定条件下建立的平衡向逆反应方向移动,可采取的措施有 (填写字母序号).
A.缩小反应容器的容积
B.扩大反应容器的容积
C.升高温度
D.使用合适的催化剂
E.设法减小平衡体系中的CO的浓度
(5)若反应③的逆反应速率与时间的关系如图所示:
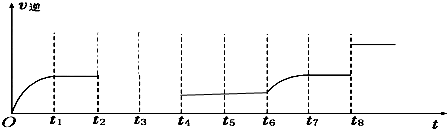
①可见反应在t1、t7时都达到了平衡,而t6、t8时都改变了一种条件,试判断改变的是什么条件:t6时 ; t8时 .
②在图中画出在t2时刻升温后t2到t4之间的逆反应速率曲线(t3时达到了平衡).
| 化学反应 | 平衡常数 | 温度 | |
| 973K | 1173K | ||
| ①Fe(s)+CO2(g)?FeO(s)+CO(g) | K1 | 1.47 | 2.15 |
| ②Fe(s)+H2O(g)?FeO(s)+H2(g) | K2 | 2.38 | 1.67 |
| ③CO(g)+H2O(g)?CO2(s)+H2(g) | K3 | ? | ? |
(1)反应②是
(2)写出反应①的平衡常数K1的表达式
(3)根据反应①与②可推导出K1、K2与K3之间的关系,则K3=
(4)要使反应③在一定条件下建立的平衡向逆反应方向移动,可采取的措施有
A.缩小反应容器的容积
B.扩大反应容器的容积
C.升高温度
D.使用合适的催化剂
E.设法减小平衡体系中的CO的浓度
(5)若反应③的逆反应速率与时间的关系如图所示:

①可见反应在t1、t7时都达到了平衡,而t6、t8时都改变了一种条件,试判断改变的是什么条件:t6时
②在图中画出在t2时刻升温后t2到t4之间的逆反应速率曲线(t3时达到了平衡).
考点:化学平衡常数的含义,化学反应速率的影响因素,化学平衡的影响因素
专题:化学平衡专题
分析:(1)由表中数据可知,升高温度平衡常数减小,说明平衡逆向移动;
(2)平衡常数为生成物浓度幂之积与反应物浓度幂之积的比;
(3)根据化学方程式相减,则平衡常数为两原平衡常数之商;
(4)判断温度变化平衡移动的方向,要使反应③在一定条件下建立的平衡向逆反应方向移动,可增大生成物的浓度或减小反应物的浓度;
(5)①该反应是一个反应前后气体体积不变的且是正反应是放热的化学反应,t6时逆反应速率逐渐增大,平衡向正反应方向移动,t8时反应速率增大,但平衡不移动,根据外界条件对化学反应速率的影响来分析解答;
②升高温度,反应速率增大,平衡逆向移动.
(2)平衡常数为生成物浓度幂之积与反应物浓度幂之积的比;
(3)根据化学方程式相减,则平衡常数为两原平衡常数之商;
(4)判断温度变化平衡移动的方向,要使反应③在一定条件下建立的平衡向逆反应方向移动,可增大生成物的浓度或减小反应物的浓度;
(5)①该反应是一个反应前后气体体积不变的且是正反应是放热的化学反应,t6时逆反应速率逐渐增大,平衡向正反应方向移动,t8时反应速率增大,但平衡不移动,根据外界条件对化学反应速率的影响来分析解答;
②升高温度,反应速率增大,平衡逆向移动.
解答:
解:(1)升高温度,化学平衡常数减小,说明平衡向逆反应方向移动,所以正反应是放热反应,故答案为:放热;
(2)Fe(s)+CO2(g)?FeO(s)+CO(g)的平衡常数表达式为
,故答案为:
;
(3)将方程式②-①得方程式③,则平衡常数K3=K2×
,故答案为:K2×
;
(4)因K3=K2×
,温度升高,K3变小,所以该反应是一个正反应是放热的化学反应且是反应前后气体体积不变的,所以压强对该反应无影响,要使该反应向逆反应方向移动,可以升高温度、增大生成物的浓度或减小反应物的浓度,
故答案为:CE;
(5)①该反应是一个反应前后气体体积不变的且是正反应是放热的化学反应,t6时逆反应速率逐渐增大,平衡向正反应方向移动,改变的条件为增大CO或H2O(g)的浓度;
t8时反应速率增大,但平衡不移动,改变的条件为增大压强或使用催化剂;
故答案为:增大CO或H2O(g)的浓度;使用催化剂或加压(减小容器的体积);
②因K3=K2×
,温度升高,K3变小,所以该反应是一个正反应是放热的化学反应,升高温度,反应速率增大,平衡逆向移动,图象为 ,故答案为:
,故答案为: .
.
(2)Fe(s)+CO2(g)?FeO(s)+CO(g)的平衡常数表达式为
| C(CO) |
| C(CO2) |
| C(CO) |
| C(CO2) |
(3)将方程式②-①得方程式③,则平衡常数K3=K2×
| 1 |
| K1 |
| 1 |
| K1 |
(4)因K3=K2×
| 1 |
| K1 |
故答案为:CE;
(5)①该反应是一个反应前后气体体积不变的且是正反应是放热的化学反应,t6时逆反应速率逐渐增大,平衡向正反应方向移动,改变的条件为增大CO或H2O(g)的浓度;
t8时反应速率增大,但平衡不移动,改变的条件为增大压强或使用催化剂;
故答案为:增大CO或H2O(g)的浓度;使用催化剂或加压(减小容器的体积);
②因K3=K2×
| 1 |
| K1 |
 ,故答案为:
,故答案为: .
.
点评:本题考查了化学平衡常数的确定、外界条件对反应速率的影响等知识点,为高频考点,侧重于学生的分析能力和计算能力的考查,注意反应前后气体体积不变的可逆反应中,压强对能改变反应速率但不影响平衡的移动,为易错点.

练习册系列答案
相关题目
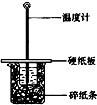 某实验小组学生按照课本实验要求,用50mL0.5mol/L的盐酸50mL0.5mol/L的NaOH溶液在如图所示的装置中进行中和反应通过测定反应过程中所放出的热量计算中和热.下列说法正确是( )
某实验小组学生按照课本实验要求,用50mL0.5mol/L的盐酸50mL0.5mol/L的NaOH溶液在如图所示的装置中进行中和反应通过测定反应过程中所放出的热量计算中和热.下列说法正确是( )| A、实验过程中没有热量损失 |
| B、图中实验装置缺少环形玻璃搅拌棒 |
| C、烧杯间填满碎纸条的作用是固定小烧杯 |
| D、若改用60 mL 0.50 mol/L盐酸跟50 mL 0.5 mol/L的 NaOH溶液进行反应,从理论上说所求中和热不相等 |
有BaCl2和NaCl的混合溶液a L,将其分成两等份.一份滴加稀硫酸,使Ba2+完全沉淀,另一份滴加AgNO3溶液,使Cl-完全沉淀.反应中分别消耗b mol的H2SO4和c mol的AgNO3.据此得知原混合溶液中的Na+的物质的量浓度为( )
A、
| ||
B、
| ||
C、
| ||
D、
|
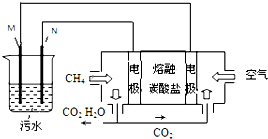 工业废水中常含有一定量的Cr2O72-,会对人类及生态系统产生很大损害,电解法是一种行之有效的除去铬的方法之一.该法用Fe和石墨作电极电解含Cr2O72-的酸性废水,最终将铬转化为Cr(OH)3沉淀,达到净化目的.某科研小组利用以上方法处理污水,设计了熔融盐电池和污水电解装置如图所示.
工业废水中常含有一定量的Cr2O72-,会对人类及生态系统产生很大损害,电解法是一种行之有效的除去铬的方法之一.该法用Fe和石墨作电极电解含Cr2O72-的酸性废水,最终将铬转化为Cr(OH)3沉淀,达到净化目的.某科研小组利用以上方法处理污水,设计了熔融盐电池和污水电解装置如图所示. 如图:a、b、c、d均为铂电极,供选择的四组电解液如下:
如图:a、b、c、d均为铂电极,供选择的四组电解液如下: