题目内容
20.化学计量在化学中占有重要地位,请回答下列问题:(1)127g FeCl2中含1mol Fe2+,2mol Cl-,总离子数3NA或者1.806×1024.
(2)3mol H2O中含有的氧原子数与1.5mol CO2中含有的氧原子数相同.
(3)已知R2+核内共有N个中子,R原子的质量数为A,其电子数为A-N-2,m g R2+中所含有的质子的物质的量为$\frac{m(A-N)}{A}$mol.
(4)1.8g H2O所含质子数与2.24L(标准状况下)NH3所含质子数相等.
分析 (1)结合n=$\frac{m}{M}$及分子构成计算;
(2)1.5mol CO2中含有的氧原子为1.5mol×2=3mol;
(3)质量数=质子数+中子数,结合失去电子判断;结合n=$\frac{m}{M}$及分子构成计算;
(4)水的质子数与氨气的质子数均为10,质子数相等,可知水与氨气的物质的量相同.
解答 解:(1)127g FeCl2中n(FeCl2)=$\frac{127g}{127g/mol}$=1mol,则含1mol Fe2+,2mol Cl-,总离子数3mol×NA=3NA或者1.806×1024,
故答案为:1;2;3NA或者1.806×1024;
(2)1.5mol CO2中含有的氧原子为1.5mol×2=3mol,则3molH2O中含有的氧原子数与1.5mol CO2中含有的氧原子数相同,
故答案为:3;
(3)R2+核内共有N个中子,R原子的质量数为A,其电子数为A-N-2,m g R2+中所含有的质子的物质的量为$\frac{m(A-N)}{A}$mol,
故答案为:A-N-2;$\frac{m(A-N)}{A}$;
(4)水的质子数与氨气的质子数均为10,质子数相等,可知水与氨气的物质的量相同,1.8g H2O的物质的量为$\frac{1.8g}{18g/mol}$=0.1mol,则氨气的体积为0.1mol×22.4L/mol=2.24L,故答案为:2.24.
点评 本题考查物质的量的计算,为高频考点,把握物质的量的基本计算公式、分子构成为解答的关键,侧重分析与计算能力的考查,题目难度不大.

练习册系列答案
相关题目
10.某元素的一种同位素原子${\;}_{Z}^{A}$X,它与3H原子组成HmX分子,在agHmX中所含中子的物质的量是( )
| A. | $\frac{a}{A}$(A-Z+2m)mol | B. | $\frac{a}{A}$(A+2m)mol | C. | $\frac{a}{A+m}$(A-Z+3m)mol | D. | $\frac{a}{A+3m}$ (A-Z+2m)mol |
11.(1)除去甲烷中的乙烯气体可用溴水(填试剂名称).实验方法为洗气(填操作名称).
(2)下列有关蒸馏乙醇和提纯苯甲酸实验的判断不正确的有b;
a.蒸馏乙醇的主要仪器有蒸馏烧瓶、温度计、冷凝管、铁架台、酒精灯、接液管和锥形瓶
b.如果温度计水银球位置低于支管口下沿,则收集的乙醇含有低沸点杂质
c.提纯苯甲酸时,用热水溶解,冷却后过滤除去固体杂质
d.测定苯甲酸晶体的熔点可能判断苯甲酸晶体是否为纯净物
(3)两种有机物A和B可以互溶,有关性质如下:
若要除去A和B的混合物中少量的B,可采用b(填代号)方法即可得到A.
a.重结晶 b.蒸馏 c.萃取 d.加水充分振荡,分液.
(2)下列有关蒸馏乙醇和提纯苯甲酸实验的判断不正确的有b;
a.蒸馏乙醇的主要仪器有蒸馏烧瓶、温度计、冷凝管、铁架台、酒精灯、接液管和锥形瓶
b.如果温度计水银球位置低于支管口下沿,则收集的乙醇含有低沸点杂质
c.提纯苯甲酸时,用热水溶解,冷却后过滤除去固体杂质
d.测定苯甲酸晶体的熔点可能判断苯甲酸晶体是否为纯净物
(3)两种有机物A和B可以互溶,有关性质如下:
| 相对密度(20℃) | 熔点 | 沸点 | 溶解性 | |
| A | 0.7893 | -117.3°C | 78.5°C | 与水以任意比混溶 |
| B | 0.7137 | -116.6°C | 34.5°C | 不溶于水 |
a.重结晶 b.蒸馏 c.萃取 d.加水充分振荡,分液.
8.某烃的结构简式为: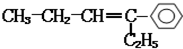 ,分子中含有四面体结构的碳原子(即饱和碳原子)数为a,在同一直线上的碳原子数量最多为b,在同一平面内的碳原子数最多为c,则a、b、c分别为( )
,分子中含有四面体结构的碳原子(即饱和碳原子)数为a,在同一直线上的碳原子数量最多为b,在同一平面内的碳原子数最多为c,则a、b、c分别为( )
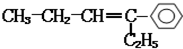 ,分子中含有四面体结构的碳原子(即饱和碳原子)数为a,在同一直线上的碳原子数量最多为b,在同一平面内的碳原子数最多为c,则a、b、c分别为( )
,分子中含有四面体结构的碳原子(即饱和碳原子)数为a,在同一直线上的碳原子数量最多为b,在同一平面内的碳原子数最多为c,则a、b、c分别为( )| A. | 4,3,10 | B. | 4,3,12 | C. | 4,2,7 | D. | 4,5,10 |
15.一种炔烃完全燃烧后,生成CO2和H2O的物质的量之比为5:4,则这种炔烃可能的结构有( )
| A. | 5种 | B. | 4种 | C. | 3种 | D. | 2种 |
12.某元素最高价氧化物对应水化物的分子式是H2RO4,则其氢化物的分子式是( )
| A. | RH4 | B. | RH3 | C. | H2R | D. | HR |
9.下列物质,全部以共价键结合的是( )
| A. | NH4Cl、CaO、HCl | B. | H2S、SiO2、HNO3 | ||
| C. | CO2、CH4、Na2O2 | D. | CH3COOH、PH3、BaSO4 |
10.下列有关金属晶体的说法中正确的是( )
| A. | 常温下都是晶体 | B. | 最外层电子数少于3个的都是金属 | ||
| C. | 金属晶体都是体心立方堆积 | D. | 都能导电、传热 |
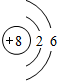 ,B的离子结构示意图
,B的离子结构示意图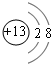 ,D的单质分子的电子式
,D的单质分子的电子式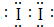 .
.