题目内容
11.下列关于电解质溶液的叙述正确的是( )| A. | 常温下电离常数为Ka的酸HA 溶液中 c (H+)=$\sqrt{{K}_{a}}$mol•L-1 | |
| B. | 将饱和Na2SO4溶液加入到饱和石灰水中,有白色沉淀产生,说明Ksp[Ca(OH)2]大于Ksp(CaSO4) | |
| C. | 0.2mol•L-1 CH3COOH溶液与0.1mol•L-1NaOH溶液等体积混合2c(H+)-2c(OH-)═c(CH3COO-)-c(CH3COOH) | |
| D. | 向0.1mol•L-1的氨水中加入少量硫酸铵固体,则溶液中$\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$增大 |
分析 A.HA为弱酸HA?H++A-,电离平衡常数Ka=$\frac{c({A}^{-})c({H}^{+})}{c(HA)}$;
B.氢氧化钙和硫酸钙阴阳离子比不同,不能用Ksp大小判断溶解性;
C.常温下,0.2mol/LCH3COOH溶液与0.1mol/LNaOH溶液等体积混合后,发生反应CH3COOH+NaOH=CH3COONa+H2O,得到等浓度的CH3COOH溶液与CH3COONa的混合溶液,溶液中醋酸电离大于醋酸根离子水解溶液显酸性,溶液中存在物料守恒和电荷守恒;
D.向0.1mol•L-1的氨水中加入少量硫酸铵固体,溶液中铵根离子浓度增大抑制一水合氨电离.
解答 解:A.HA为弱酸HA?H++A-,电离平衡常数Ka=$\frac{c({A}^{-})c({H}^{+})}{c(HA)}$,c(H+)=$\sqrt{Ka×c(HA)}$mol/L,故A错误;
B.将饱和Na2SO4溶液加入到饱和石灰水中,有白色沉淀产生,说明c(Ca2+)c(SO42-)≥Ksp(CaSO4),但不能说明Ksp[Ca(OH)2]大于Ksp(CaSO4),故B错误;
C.常温下,0.2mol/LCH3COOH溶液与0.1mol/LNaOH溶液等体积混合后,发生反应CH3COOH+NaOH=CH3COONa+H2O,得到等浓度的CH3COOH溶液与CH3COONa的混合溶液,溶液中存在物料守恒c(CH3COO-)+c(CH3COOH)=2c(Na+)=2×$\frac{0.1mol/L}{2}$=0.1mol/L,
溶液中存在电荷守恒:c(CH3COO-)+c(OH-)=c(Na+)+c(H+),物料守恒c(CH3COO-)+c(CH3COOH)=2c(Na+),代入计算得到:2c(OH-)+c(CH3COO-)=c(CH3COOH)+2c(H+),故C正确;
D.向0.1mol•L-1的氨水中加入少量硫酸铵固体,溶液中铵根离子浓度增大抑制一水合氨电离,氢氧根离子浓度减小,一水合氨浓度增大,$\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$比值减小,故D错误;
故选C.
点评 本题考查了弱电解质电离平衡、溶度积常数比较、电解质溶液中电荷守恒和物料守恒计算、掌握基础是解题关键,题目难度中等.

| A. | 电池的电解液为碱性溶液,正极为Ni2O3、负极为Fe | |
| B. | 电池放电时,负极反应为Fe-2e-═Fe2+ | |
| C. | 电池充电过程中,阴极附近溶液的pH升高 | |
| D. | 电池充电时,阳极反应为2Ni(OH)2+2OH--2e-═Ni2O3+3H2O |
| A. | 2Na+2H2O═2NaOH+H2↑ | B. | 2HClO$\frac{\underline{\;光照\;}}{\;}$2HCl+O2 | ||
| C. | CuO+CO$\frac{\underline{\;高温\;}}{\;}$Cu+CO2 | D. | Fe+2FeCl3═3FeCl2 |
| A. | 用托盘天平称取3.2gNaCl固体 | |
| B. | 用10mL量筒量取7.50mL稀盐酸 | |
| C. | 固体称量时,天平游码读数0.15g | |
| D. | 用广泛pH试纸测得某溶液的pH为3.5 |
| A. | 摩尔是七个基本物理量之一 | |
| B. | 硫酸钠和水分别属于非电解质和弱电解质 | |
| C. | 硫酸、纯碱、醋酸钠和生石灰分别属于酸、碱、盐和氧化物 | |
| D. | 分散系中分散质粒子的直径:Fe(OH)3浊液>Fe(OH)3胶体>FeCl3溶液 |
| A. | n(CO2)=0.1时,c(Na+)>c(AlO2-)>c(CO32-)>c(OH-) | |
| B. | 0.1mol<n(CO2)<0.15时发生的反应是:Na2CO3+CO2+H2O═2NaHCO3 | |
| C. | n(CO2)=0.15时,c(Na+)>c(CO32-)>c(HCO3-)>c(OH-) | |
| D. | n(CO2)=0.3时,c(Na+)>c(HCO3-)>c(OH-)>c(CO32-)>c(H+) |
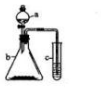 利用右下图所示的装置进行实验,将仪器a中的溶液滴入b中,根据c中所盛溶液,预测c中现象正确的是( )
利用右下图所示的装置进行实验,将仪器a中的溶液滴入b中,根据c中所盛溶液,预测c中现象正确的是( )| 选项 | a | b | c | c试管中的现象 |
| A | 浓盐酸 | KMnO4 | FeCl2溶液 | 溶液变棕黄色 |
| B | 稀硫酸 | Na2S2O3 | 溴水 | 产生浅黄色沉淀 |
| C | 饱和NaCl | CaC2 | 硫酸铜溶液 | 产生蓝色沉淀 |
| D | 浓硝酸 | 铁片 | KI-淀粉溶液 | 溶液变蓝色 |
| A. | A | B. | B | C. | C | D. | D |
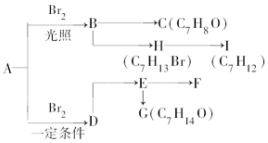 A是分子式为C7H8的芳香烃,已知它存在以下一系列转化关系,其中C是一种一元醇,D是A的对位一取代物,H与E、I与F分别互为同分异构体:
A是分子式为C7H8的芳香烃,已知它存在以下一系列转化关系,其中C是一种一元醇,D是A的对位一取代物,H与E、I与F分别互为同分异构体: ,
, .
.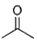 根据键线式回答下列问题:
根据键线式回答下列问题: 分子式:C5H9O2,结构简式:CH2=C(CH3)COOCH3
分子式:C5H9O2,结构简式:CH2=C(CH3)COOCH3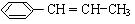 )在催化剂作用下生成聚苯丙烯的反应方程式:
)在催化剂作用下生成聚苯丙烯的反应方程式:
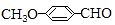 有多种的同分异构体,其中属于芳香族羧酸的同分异构体共有4种,它们的结构简式是:
有多种的同分异构体,其中属于芳香族羧酸的同分异构体共有4种,它们的结构简式是: ;
; ;
; ,
, (任意一种);、(任写其中一种)
(任意一种);、(任写其中一种)