题目内容
8.甲苯是由苯环和甲基结合而成的,甲苯能使酸性高锰酸钾溶液褪色,这是因为( )| A. | 烷烃能使酸性高锰酸钾溶液褪色 | B. | 苯环能使酸性高锰酸钾溶液褪色 | ||
| C. | 甲基使苯环的活性增强 | D. | 苯环使甲基的活性增强 |
分析 甲苯能使酸性高锰酸钾溶液褪色,因苯环影响甲基,使甲基被氧化生成-COOH,以此来解答.
解答 解:A.烷烃与高锰酸钾不反应,故A错误;
B.苯环不能与高锰酸钾反应,故B错误;
C.甲苯能使酸性高锰酸钾溶液褪色,因苯环使甲基的活性增强,故C错误;
D.甲苯能使酸性高锰酸钾溶液褪色,因苯环影响甲基,使甲基的活性增强,则甲基被氧化生成-COOH,故D正确;
故选D.
点评 本题考查有机物的结构与性质,为高频考点,把握苯与甲苯性质的区别为解答的关键,侧重分析与应用能力的考查,注意苯环对甲基的影响,题目难度不大.

练习册系列答案
相关题目
19.某同学在实验报告中记录下列数据,其中正确的是( )
| A. | 用托盘天平称取3.2gNaCl固体 | |
| B. | 用10mL量筒量取7.50mL稀盐酸 | |
| C. | 固体称量时,天平游码读数0.15g | |
| D. | 用广泛pH试纸测得某溶液的pH为3.5 |
16.下列说法正确的是( )
| A. | 摩尔是七个基本物理量之一 | |
| B. | 硫酸钠和水分别属于非电解质和弱电解质 | |
| C. | 硫酸、纯碱、醋酸钠和生石灰分别属于酸、碱、盐和氧化物 | |
| D. | 分散系中分散质粒子的直径:Fe(OH)3浊液>Fe(OH)3胶体>FeCl3溶液 |
3.向1L含0.1mol/LNaAlO2和0.2mol/LNaOH的溶液中缓缓通入二氧化碳,随n(CO2)增大,先后发生三个反应.已知酸性:H2CO3>HCO3->Al(OH)3.下列说法正确的是( )
| A. | n(CO2)=0.1时,c(Na+)>c(AlO2-)>c(CO32-)>c(OH-) | |
| B. | 0.1mol<n(CO2)<0.15时发生的反应是:Na2CO3+CO2+H2O═2NaHCO3 | |
| C. | n(CO2)=0.15时,c(Na+)>c(CO32-)>c(HCO3-)>c(OH-) | |
| D. | n(CO2)=0.3时,c(Na+)>c(HCO3-)>c(OH-)>c(CO32-)>c(H+) |
17. X、Y、Z、W是四种常见的短周期主族元素,其原子半径随原子序数的变化如图所示. 已知Y、Z两种元素的单质是空气的主要成分,W原子的最外层电子数与Ne原子的最外层电子数相差l.下列说法正确的是( )
X、Y、Z、W是四种常见的短周期主族元素,其原子半径随原子序数的变化如图所示. 已知Y、Z两种元素的单质是空气的主要成分,W原子的最外层电子数与Ne原子的最外层电子数相差l.下列说法正确的是( )
 X、Y、Z、W是四种常见的短周期主族元素,其原子半径随原子序数的变化如图所示. 已知Y、Z两种元素的单质是空气的主要成分,W原子的最外层电子数与Ne原子的最外层电子数相差l.下列说法正确的是( )
X、Y、Z、W是四种常见的短周期主族元素,其原子半径随原子序数的变化如图所示. 已知Y、Z两种元素的单质是空气的主要成分,W原子的最外层电子数与Ne原子的最外层电子数相差l.下列说法正确的是( )| A. | Y、Z、W处于同一周期 | |
| B. | X、Y、Z、W的原子序数递增 | |
| C. | X、W可形成化学式为XW的离子化合物 | |
| D. | 简单离子半径是Z大于W |
18.A、B、C、D、E六种物质的转化关系如图所示(未标出反应条件),A、D、F都是由短周期非金属元素形成的单质,B、C、E都是二元化合物.A、F所含元素同周期,下列说法不正确的是( )

| A. | A、D所含元素的原子序数大小:A一定比D小 | |
| B. | A、F所含元素的原子半径大小:A一定比F大 | |
| C. | B、E含有化学键类型相同 | |
| D. | 若常温下D为固体,则B可以与NaOH溶液反应 |
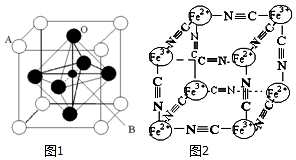 Ti、Fe、Cr、Mn等均为过渡元素,在生产生活中起着不可替代的重要作用,对其单质和化合物的应用研究是目前科学研究的前沿之一.请回答下列问题:
Ti、Fe、Cr、Mn等均为过渡元素,在生产生活中起着不可替代的重要作用,对其单质和化合物的应用研究是目前科学研究的前沿之一.请回答下列问题: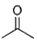 根据键线式回答下列问题:
根据键线式回答下列问题: 分子式:C5H9O2,结构简式:CH2=C(CH3)COOCH3
分子式:C5H9O2,结构简式:CH2=C(CH3)COOCH3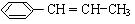 )在催化剂作用下生成聚苯丙烯的反应方程式:
)在催化剂作用下生成聚苯丙烯的反应方程式:
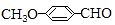 有多种的同分异构体,其中属于芳香族羧酸的同分异构体共有4种,它们的结构简式是:
有多种的同分异构体,其中属于芳香族羧酸的同分异构体共有4种,它们的结构简式是: ;
; ;
; ,
, (任意一种);、(任写其中一种)
(任意一种);、(任写其中一种)