题目内容
14.为治理环境,减少雾霾,应采取措施减少氮氧化物(NOx)的排放量.还原法、氧化法、电化学吸收法是减少氮氧化物排放的有效措施.
(1)科学家研究利用乙烯进行脱硝(NO),反应机理如图1.由图 可推断:乙烯的作用是作还原剂,Cu+的作用是作催化剂.
(2)选择性催化还原技术(SCR)是目前最成熟的烟气脱硝技术,其反应原理为:
4NH3(g)+4N0(g)+O2(g)?4N2(g)+6H20(g)△H=-1625.5kJ•mol-1
①该方法应控制反应温度在315〜400℃之间,反应温度不宜过高的原因是温度过高,使脱硝的主要反应的平衡向逆方向移动,脱硝率降低.
②氨氮比[n(NH3)/n(NO)]会直接影响该方法的脱硝率.如图2为350℃时,只改变氨气的投放量,NO的百分含量与氨氮比的关系图,当 n(NH3)/n(NO)>l.0 时,烟气中NO含量反而增大,主要原因是 过量氨气与氧气反应生成NO.
(3)烟气脱硫(SO2)脱硝(NOx)一体化技术是大气污染防治研究的热点.用次氯酸钙溶液同时脱除烟气中SO2和NO的原理如下:
脱硫:Ca(ClO)2(aq)+2SO2(g)+2H2O(1)=CaSO4(s)+H2SO4(aq)+2HCl(aq)Ⅰ
脱酸:3Ca(ClO)2(aq)+2NO(g)+2H2O(1)=3CaCl2(s)+HNO3(aq)Ⅱ
①与NaClO溶液相比,Ca(C10)2溶液更能有效促进脱硫反应进行,理由是CaSO4微溶,反应体系中的Ca2+有利于CaSO4沉淀的生成,促进吸收反应进行.
②已知NaOH溶液脱销的原理:2NO2+2NaOH═NaNO2+NaNO3+H2O,
NO+NO2+2NaOH═2NaNO2+H2O与 NaOH 溶液相比,Ca(ClO)2 溶液脱销效率更高,可能的原因是ClO-氧化性强,有利于将NO氧化为它们的最高价态NO3-.
(4)直接电解吸收也是脱硝的-种方法.用6%的稀硝酸吸收NOx生成亚硝酸,再将吸收液导入电解槽使之转化为硝酸.电解装置如图3所示.将石墨电极设置成颗粒状的目的是增大吸收液与电极的接触面积,提高电解反应的效率;该电池的阳扱方程式为H2O+HNO2-2e-=3H++NO3-.
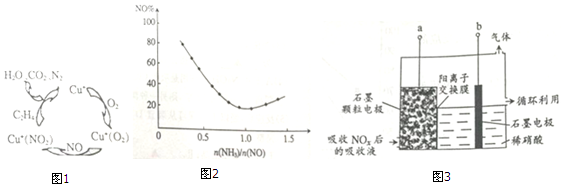
分析 (1)氧化还原反应中元素化合价降低被还原,自身为氧化剂,元素化合价升高被氧化,自身为还原剂,用乙烯进行脱硝(NO),从图示可知,乙烯被氧化成二氧化碳,Cu+在反应前后不变为催化剂;
(2)①根据温度对速率和化学平衡的影响分析;②根据过量氨气与氧气的反应的产物分析;
(3)①Ca(ClO)2法更能促进脱硫反应进行是因为反应Ⅰ中生成微溶于水的硫酸钙,浓度大的溶液中会生成沉淀;
②NO难溶于水,碱液对NOx的脱除效率较低;ClO-氧化性强,有利于将NO 氧化为它们的最高价态NO3-;
(4)电极的面积越大,与溶液的接触越充分,电解效率越高;电解吸收也是脱硝的一种方法.用6%的稀硝酸吸收NOx生成亚硝酸,再将吸收液导入电解槽电解,使之转化为硝酸,阳极上亚硝酸失电子发生氧化反应.
解答 解:(1)用乙烯进行脱硝(NO),从图示可知,乙烯被NO氧化成二氧化碳(其中C由-2→+4),NO自身被还原成N2(其中N由+2→0),催化剂在化学反应前后性质、质量不变,图示中Cu+在反应前后不变,为催化剂,
故答案为:作还原剂;作催化剂;
(2)①该方法应控制反应温度在315~400℃之间,反应温度不宜过低也不宜过高,温度越高反应速率越快,温度过低,反应速率小,温度过高,使脱硝的主要反应的平衡向逆方向移动,脱硝率降低,
故答案为:温度过高,使脱硝的主要反应的平衡向逆方向移动,脱硝率降低;
②当$\frac{n(N{H}_{3})}{n(NO)}$>1.0时,过量的氨气与氧气的反应生成NO,所以烟气中NO浓度增大,
故答案为:过量氨气与氧气反应生成NO;
(3)①反应Ⅰ脱硫:Ca(ClO)2(aq)+2SO2(g)+2H2O(l)=CaSO4(s)+H2SO4(aq)+2HCl(aq),反应中生成微溶于水的硫酸钙,反应体系中的Ca2+有利于CaSO4沉淀的生成,促进吸收反应进行,
故答案为:CaSO4微溶,反应体系中的Ca2+有利于CaSO4沉淀的生成,促进吸收反应进行;
②与NaOH溶液吸收法相比,Ca(ClO)2法的脱硫脱硝效率更高,NO难溶于水,碱液对NOx的脱除效率较低,ClO-氧化性强,有利于将NO氧化为它们的最高价态NO3-,达到高效率脱除的目的,
故答案为:ClO-氧化性强,有利于将NO氧化为它们的最高价态NO3-;
(4)电极的面积越大,与溶液的接触越充分,电解效率越高,所以将石墨电极设置成颗粒状的目的是增大吸收液与电极的接触面积,提高电解反应的效率,电解吸收也是脱硝的一种方法.用6%的稀硝酸吸收NOx生成亚硝酸,再将吸收液导入电解槽电解,使之转化为硝酸,阳极上亚硝酸失电子发生氧化反应,阳极电极反应为:H2O+HNO2-2e-=3H++NO3-,
故答案为:增大吸收液与电极的接触面积,提高电解反应的效率;H2O+HNO2-2e-=3H++NO3-.
点评 本题考查了氧化还原、影响反应速率和化学平衡移动的因素、电解原理的应用,题目综合性较强,难度中等,侧重于考查学生的分析能力和对基础知识的综合应用能力,注意把握题目中所给图示的含义.

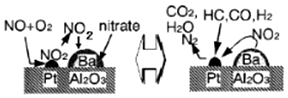
下列说法不正确的是( )
| A. | 该机理研究的是汽车尾气催化转化机理 | |
| B. | CO在催化剂表面被还原生成CO2,铂起催化作用 | |
| C. | CO在催化剂表面可能和O2、NO反应 | |
| D. | NO、CO均能与人体中的血红蛋白结合 |
| A. | 2Na+2H2O═2NaOH+H2↑ | B. | 2HClO$\frac{\underline{\;光照\;}}{\;}$2HCl+O2 | ||
| C. | CuO+CO$\frac{\underline{\;高温\;}}{\;}$Cu+CO2 | D. | Fe+2FeCl3═3FeCl2 |
 某50mL溶液中可能含有H+、Na+、Mg2+、Al3+、SO42-、NH4+离子,当向该溶液中加入5mol/L的NaOH溶液时,发现生成沉淀的物质的量n(沉淀)随NaOH溶液的体积v(NaOH)变化关系如图所示.( )
某50mL溶液中可能含有H+、Na+、Mg2+、Al3+、SO42-、NH4+离子,当向该溶液中加入5mol/L的NaOH溶液时,发现生成沉淀的物质的量n(沉淀)随NaOH溶液的体积v(NaOH)变化关系如图所示.( )| A. | 原溶液中一定含有的阳离子是H+、Mg2+、Al3+ | |
| B. | 原溶液中Al3+的浓度为lmol/L | |
| C. | 原溶液中NH4+的物质的量为0.4 mol | |
| D. | 当加入的NaOH溶液的体积为90mL时,反应后溶液中的离子只有Na+和SO42- |
| A. | 用托盘天平称取3.2gNaCl固体 | |
| B. | 用10mL量筒量取7.50mL稀盐酸 | |
| C. | 固体称量时,天平游码读数0.15g | |
| D. | 用广泛pH试纸测得某溶液的pH为3.5 |
| A. | n(CO2)=0.1时,c(Na+)>c(AlO2-)>c(CO32-)>c(OH-) | |
| B. | 0.1mol<n(CO2)<0.15时发生的反应是:Na2CO3+CO2+H2O═2NaHCO3 | |
| C. | n(CO2)=0.15时,c(Na+)>c(CO32-)>c(HCO3-)>c(OH-) | |
| D. | n(CO2)=0.3时,c(Na+)>c(HCO3-)>c(OH-)>c(CO32-)>c(H+) |
| A. | 3.6mol/L | B. | 3.2mol/L | C. | 2.8mol/L | D. | 2.4mol/L |
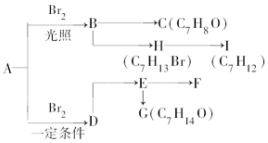 A是分子式为C7H8的芳香烃,已知它存在以下一系列转化关系,其中C是一种一元醇,D是A的对位一取代物,H与E、I与F分别互为同分异构体:
A是分子式为C7H8的芳香烃,已知它存在以下一系列转化关系,其中C是一种一元醇,D是A的对位一取代物,H与E、I与F分别互为同分异构体: ,
, .
.