题目内容
5.下列各组离子,在指定条件下不能大量共存的是( )①某无色透明的酸性溶液中:Cl-、Na+、MnO4-、SO42-
②水电离产生的c(H+)=10-12mol•L-1的溶液中:K+、Na+、Cl-、NO3-
③使紫色石蕊溶液变红的溶液中:Fe2+、Mg2+、NO3-、Cl-
④加入过量NaOH溶液后可得到澄清溶液:K+、Ba2+、HCO3-、Cl-
⑤c(H+)<c(OH-)的溶液中:SO32-、S2-、K+、Na+
⑥在酸性高锰酸钾溶液中:Na+、NH4+、I-、ClO-
⑦能使pH试纸变蓝色的溶液中:Na+、AlO2-、K+、CO32-.
| A. | ①③④⑥ | B. | ②③⑤⑦ | C. | ②⑤⑦ | D. | ②④⑤⑦ |
分析 ①无色溶液不存在有颜色的离子;
②水电离产生的c(H+)=10-12mol•L-1的溶液可能呈酸性或碱性;
③使紫色石蕊溶液变红的溶液呈酸性;
④碱性条件下Ba2+、HCO3-反应生成沉淀;
⑤c(H+)<c(OH-)的溶液呈碱性;
⑥在性高锰酸钾溶液具有强氧化性;
⑦能使pH试纸变蓝色的溶液呈碱性.
解答 解:①MnO4-呈紫色,与题目无色不符,故错误;
②水电离产生的c(H+)=10-12mol•L-1的溶液可能呈酸性或碱性,离子之间不发生任何反应,可大量共存,故正确;
③使紫色石蕊溶液变红的溶液呈酸性,Fe2+、NO3-发生氧化还原反应而不能大量共存,故错误;
④碱性条件下Ba2+、HCO3-反应生成沉淀,不能大量共存,故错误;
⑤c(H+)<c(OH-)的溶液呈碱性,离子之间不发生任何反应,可大量共存,故正确;
⑥在性高锰酸钾溶液具有强氧化性,I-不能大量共存,且I-、ClO-发生氧化还原反应,故错误;
⑦能使pH试纸变蓝色的溶液呈碱性,离子之间不发生任何反应,可大量共存,故正确.
故选A.
点评 本题考查离子的共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重复分解反应、氧化还原反应的离子共存及分析与应用能力的综合考查,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
5.用NA表示阿伏加德罗常致,下列说法正确的是( )
| A. | 将lmol Cl2溶于水,所得溶液中HClO、Cl-和C1O-的总数目为2NA | |
| B. | 46g NO2和N2O4混合物中含分子数为NA | |
| C. | 氢氧燃料电池正极消耗22.4L气体时,电路中通过的电子数目为4NA | |
| D. | 适量Na2O2与CO2反应生成1mol O2时,转移的电子数为2NA |
6.如图是实验室制取无水氯化镁的装置图,下列有关表述不正确的是( )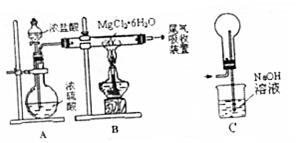

| A. | 装置A制取HCl利用了浓硫酸的吸水性 | |
| B. | 如果直接加热MgCl2•6H2O不能得到MgCl2,将得到Mg(OH)Cl或MgO | |
| C. | 用装置C做为尾气吸收装置,直接与B相连 | |
| D. | 这套装置在设计时未考虑反应结束后滞留在装置中的有害气体的吸收 |
20.下列说法中正确的为( )
| A. | 1 mol氢约含有阿伏伽德罗常数个氢 | |
| B. | 1 molCaCl2 含有1 molCl- | |
| C. | 1 mol电子约含有 6.02×1023个电子 | |
| D. | 1 mol H2O 含有 1 mol H2 和 1 mol O |
10.某校科技活动小组的同学采集酸雨样品,每隔一段时间测定pH,得到下列数据:
请根据上述材料,回答下列有关问题:酸雨放置时,pH发生变化的主要原因为酸雨样品中的H2SO3逐渐被氧化成H2SO4,使溶液的酸性增强.
| 时间 | 开始 | 8h后 | 16h 后 | 24h后 | 32h后 | 40h后 | 48h后 |
| pH | 5.0 | 4.8 | 4.5 | 4.3 | 4.2 | 4.0 | 4.0 |
14.下列叙述正确的是( )
| A. | 直径介于1nm~100nm之间的微粒称为胶体 | |
| B. | 电泳现象可证明胶体带电 | |
| C. | 渗析法可用于含有氯化钠的淀粉溶液的提纯 | |
| D. | 用含1molFeCl3的溶液可制得6.02×1023个Fe(OH)3胶体粒子 |
15.已知 X、Y 为第三周期非金属元素(稀有气体除外),且电负性 X>Y,下列说法错误的 是( )
| A. | X 与 Y 形成化合物时,X 可能显负价,也可能显正价 | |
| B. | 第一电离能 X 可能小于 Y | |
| C. | X 的最高价含氧酸的酸性强于 Y 的最高价含氧酸的酸性 | |
| D. | 原子序数 X 一定大于 Y |