题目内容
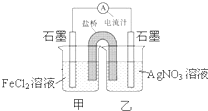 控制适合的条件,将反应Ag+Fe3+?Fe2++Ag+ 设计成如图所示的原电池.下列判断错误的是( )
控制适合的条件,将反应Ag+Fe3+?Fe2++Ag+ 设计成如图所示的原电池.下列判断错误的是( )| A、反应开始时,电子从甲中石墨经导线流向乙中石墨 |
| B、电流计指针为零时,上述反应的正反应速率等于逆反应速率 |
| C、电流计读数为零后,在甲中加入FeCl3固体,甲中石墨电极为负极 |
| D、电流计读数为零后,在甲中加入双氧水,甲中石墨电极反应式是Fe3++e-=Fe2+ |
考点:原电池和电解池的工作原理
专题:电化学专题
分析:A.该原电池中,亚铁离子失电子发生氧化反应,所以甲中石墨作负极,乙中石墨作正极,电子从负极沿导线流向正极;
B.电流计指针为0时,该反应达到平衡状态;
C.电流计指针为0后,在甲中加入FeCl3固体,平衡向正反应方向进行;
D.电流计指针为0后,在甲中加入双氧水,生成Fe3+,平衡向正反应方向移动.
B.电流计指针为0时,该反应达到平衡状态;
C.电流计指针为0后,在甲中加入FeCl3固体,平衡向正反应方向进行;
D.电流计指针为0后,在甲中加入双氧水,生成Fe3+,平衡向正反应方向移动.
解答:
解:A.该原电池中,亚铁离子失电子发生氧化反应,所以甲中石墨作负极,乙中石墨作正极,电子从负极沿导线流向正极,所以电子从甲中石墨经导线流向乙中石墨,故A正确;
B.当电流计为零时,说明没有电子发生转移,则反应达到平衡,正逆反应速率相等,故B正确;
C.电流计指针为0后,在甲中加入FeCl3固体,平衡向正反应方向进行,则Fe3+被还原,甲为正极,乙为负极,故C错误;
D.电流计指针为0后,在甲中加入双氧水,生成Fe3+,平衡向正反应方向进行,则Fe3+被还原,甲中石墨电极反应式是Fe3++e-=Fe2+,故D正确.
故选C.
B.当电流计为零时,说明没有电子发生转移,则反应达到平衡,正逆反应速率相等,故B正确;
C.电流计指针为0后,在甲中加入FeCl3固体,平衡向正反应方向进行,则Fe3+被还原,甲为正极,乙为负极,故C错误;
D.电流计指针为0后,在甲中加入双氧水,生成Fe3+,平衡向正反应方向进行,则Fe3+被还原,甲中石墨电极反应式是Fe3++e-=Fe2+,故D正确.
故选C.
点评:本题是对原电池原理综合考查,并注重与化学平衡的联系,学生明确原电池的工作原理、正负极的判断方法、化学平衡的移动即可解答,注意该反应是可逆反应,为易错点.

练习册系列答案
相关题目
在25℃、101KPa下,1g甲醇燃烧生成CO2和液态水时放热22.68KJ,下列热化学方程正确的是( )
A、CH3OH(l)+
| ||
| B、2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l)△H=-1452KJ/mol | ||
C、CH3OH(l)+
| ||
| D、2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H=-1452KJ/mol |
设NA为阿伏加德罗常数的值,下列有关叙述正确的是( )
| A、标准状况下,边长为28.2cm(内空)的立方体容器内所盛有的N2的分子数目约为NA |
| B、在熔融状态下,l mol NaHSO4完全电离出的阳离子数目为2NA |
| C、7.8 g Na2O2含有的阴离子数目为0.2 NA |
| D、标准状况下,22.4L庚烷完全燃烧生成的CO2分子数目为7NA |

