题目内容
设NA为阿伏加德罗常数的值,下列有关叙述正确的是( )
| A、标准状况下,边长为28.2cm(内空)的立方体容器内所盛有的N2的分子数目约为NA |
| B、在熔融状态下,l mol NaHSO4完全电离出的阳离子数目为2NA |
| C、7.8 g Na2O2含有的阴离子数目为0.2 NA |
| D、标准状况下,22.4L庚烷完全燃烧生成的CO2分子数目为7NA |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A、根据n=
和N=n?NA来计算;
B、注意区分熔融状态和溶液中NaHSO4发生不同的电离,阳离子不同,在熔融状态下形成的Na+和HSO4-;
C、注意过氧化钠的过氧键,两个氧原子共同形成一个过氧根离子O22-;
D、标况下,庚烷为液态.
| V |
| Vm |
B、注意区分熔融状态和溶液中NaHSO4发生不同的电离,阳离子不同,在熔融状态下形成的Na+和HSO4-;
C、注意过氧化钠的过氧键,两个氧原子共同形成一个过氧根离子O22-;
D、标况下,庚烷为液态.
解答:
解:A、28.2cm(内空)的立方体容器的体积为22425cm3即22.4L,故氮气的物质的量n=
=1mol,故含有的分子数目为NA个,故A正确;
B、熔化状态下能电离的只能是原有的离子键,所以形成的是Na+、HSO4-,即阳离子为NA,故B错误;
C、氧原子个数起干扰作用,实质上两个氧原子共同形成一个过氧根离子O22-,即为0.1 NA,故C错误;
D、标况下,庚烷为液态,故D错误.
故选A.
| V |
| Vm |
B、熔化状态下能电离的只能是原有的离子键,所以形成的是Na+、HSO4-,即阳离子为NA,故B错误;
C、氧原子个数起干扰作用,实质上两个氧原子共同形成一个过氧根离子O22-,即为0.1 NA,故C错误;
D、标况下,庚烷为液态,故D错误.
故选A.
点评:本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 小学课时特训系列答案
小学课时特训系列答案
相关题目
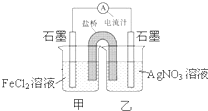 控制适合的条件,将反应Ag+Fe3+?Fe2++Ag+ 设计成如图所示的原电池.下列判断错误的是( )
控制适合的条件,将反应Ag+Fe3+?Fe2++Ag+ 设计成如图所示的原电池.下列判断错误的是( )| A、反应开始时,电子从甲中石墨经导线流向乙中石墨 |
| B、电流计指针为零时,上述反应的正反应速率等于逆反应速率 |
| C、电流计读数为零后,在甲中加入FeCl3固体,甲中石墨电极为负极 |
| D、电流计读数为零后,在甲中加入双氧水,甲中石墨电极反应式是Fe3++e-=Fe2+ |
用酒精灯加热下列溶液,蒸干后灼烧,所得固体质量最大的是( )
| A、20 mL 2 mol/L FeCl3溶液 |
| B、40 mL 1 mol/L NaHCO3溶液 |
| C、20 mL 1 mol/L Na2SO3溶液 |
| D、40 mL 2 mol/L NH4HCO3溶液 |
常温下,在密闭容器中分别充人等物质的量的两种气体,在一定条件下充分反应后,恢复到原温度时,压强降低为开始时的
.则原混合气体可能是( )
| 1 |
| 4 |
| A、H2和O2 |
| B、HCl和NH3 |
| C、H2和Cl2 |
| D、NO和O2 |
下列物质加入水中,显著放热的是( )
| A、熟石灰 |
| B、固体NaOH |
| C、固体NaCl |
| D、固体硝酸铵 |
下列反应既是离子反应,又是氧化还原反应的是( )
| A、氯化钠溶液中滴入硝酸银溶液 |
| B、铁片置于硫酸铜溶液中 |
| C、金属钠在氯气中燃烧 |
| D、二氧化碳通入澄清石灰水中 |
下列离子方程式书写正确的是( )
| A、在碘化亚铁溶液中通入足量氯气:2Fe2++2I-+2Cl2=2Fe3++I2+4Cl- | ||||
B、用铜电极电解氯化钠饱和溶液:2Cl-+2H2O
| ||||
| C、向硫酸亚铁溶液中通入H2S气体:Fe2++H2S=FeS↓+2H+ | ||||
| D、硫酸亚铁酸性溶液中加入过氧化氢:4Fe2++2H2O2+4H+=4Fe3++4H2O |
 已知有机物A的分子式为C10H12O3,A分子的苯环上只有一个侧链且无甲基,若用M表示A的相对分子质量,与A有关的有机物转化关系如下:
已知有机物A的分子式为C10H12O3,A分子的苯环上只有一个侧链且无甲基,若用M表示A的相对分子质量,与A有关的有机物转化关系如下: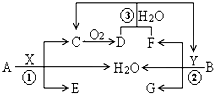 已知两种常见金属A、B分别与两种酸X、Y发生反应各生成三种产物,其转化关系如图所示,其中D为红棕色气体,G溶液呈蓝色.
已知两种常见金属A、B分别与两种酸X、Y发生反应各生成三种产物,其转化关系如图所示,其中D为红棕色气体,G溶液呈蓝色.