题目内容
A、B、C三元素原子的核外电子数都比氩原子少,A和C处于同主族,两者间隔一周期,A元素和B元素的原子两者核电荷数之差为5,B原子核外第3电子层比第2电子层少两个电子,则B的原子结构示意图为 ;B与C形成化合物的化学式是 ,它的电子式是 ,它属于 化合物(填“离子”或“共价”);A与B形成化合物的化学式是 ,它的电子式是 ,它属于 化合物.
考点:原子结构与元素的性质
专题:元素周期律与元素周期表专题
分析:A、B、C三元素原子的核外电子数都比氩原子少,B原子核外第3电子层比第2电子层少两个电子,最外层电子数为6,则B为S元素,A元素和B元素的原子两者核电荷数之差为5,故A为Na元素,A和C处于同主族,两者间隔一周期,则C为H元素,据此解答.
解答:
解:A、B、C三元素原子的核外电子数都比氩原子少,B原子核外第3电子层比第2电子层少两个电子,最外层电子数为6,则B为S元素,A元素和B元素的原子两者核电荷数之差为5,故A为Na元素,A和C处于同主族,两者间隔一周期,则C为H元素,则:
B为S元素,原子结构示意图为 ;B与C形成化合物的化学式是H2S,它的电子式是
;B与C形成化合物的化学式是H2S,它的电子式是 ,它属于共价化合物,A与B形成化合物是Na2S,它的电子式是
,它属于共价化合物,A与B形成化合物是Na2S,它的电子式是 ,它属于离子化合物,
,它属于离子化合物,
故答案为: ; H2S;
; H2S; ;共价; Na2S;
;共价; Na2S; ;离子.
;离子.
B为S元素,原子结构示意图为
 ;B与C形成化合物的化学式是H2S,它的电子式是
;B与C形成化合物的化学式是H2S,它的电子式是 ,它属于共价化合物,A与B形成化合物是Na2S,它的电子式是
,它属于共价化合物,A与B形成化合物是Na2S,它的电子式是 ,它属于离子化合物,
,它属于离子化合物,故答案为:
 ; H2S;
; H2S; ;共价; Na2S;
;共价; Na2S; ;离子.
;离子.
点评:本题考查结构与位置关系,比较基础,侧重对化学用语的考查,注意基础知识的掌握.

练习册系列答案
相关题目
某溶液中含有两种溶质NaCl和H2SO4,它们的物质的量之比为3:1.用石墨做电极电解该混合溶液时,根据电极产物,可明显分为三个阶段,下列叙述不正确的是( )
| A、阴极自始至终只有H2 |
| B、阳极先析出Cl2后析出O2 |
| C、电解最后阶段为电解水 |
| D、溶液pH不断增大,最后为7 |
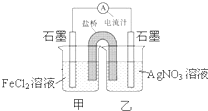 控制适合的条件,将反应Ag+Fe3+?Fe2++Ag+ 设计成如图所示的原电池.下列判断错误的是( )
控制适合的条件,将反应Ag+Fe3+?Fe2++Ag+ 设计成如图所示的原电池.下列判断错误的是( )| A、反应开始时,电子从甲中石墨经导线流向乙中石墨 |
| B、电流计指针为零时,上述反应的正反应速率等于逆反应速率 |
| C、电流计读数为零后,在甲中加入FeCl3固体,甲中石墨电极为负极 |
| D、电流计读数为零后,在甲中加入双氧水,甲中石墨电极反应式是Fe3++e-=Fe2+ |
下列各组离子在相应的条件下一定能大量共存的是( )
| A、与铝粉反应放出氢气的无色溶液中:NO3-、Mg2+、Na+、SO42- | ||
B、在
| ||
| C、水电离出的c(H+)=1×10-13mol/L的溶液中,K+、CO32-、Cl-、S2- | ||
| D、在pH=3的无色溶液中:Fe3+、C1-、NO3-、A13+ |
X、Y、Z和R为原子序数依次递增的四种元素,其中X、Y、Z属于短周期元素,X是自然界中构成化合物种类最多的元素且具有多种同素异形体,Y的最高正价是最低负价绝对值的3倍,Y、Z同周期,Z、R同主族.下列说法不正确的是( )
| A、80R的核内含有40个中子 |
| B、Y、Z、R的氢化物对应酸的酸性逐渐增强 |
| C、X、Y、R、Z单质的氧化性依次增强 |
| D、X单质与Y的最高价氧化物对应的水化物共热可生成两种气体 |
取一定质量的均匀固体混合物Cu、Cu2O和 CuO,将其分成两等份,取其中一份用足量的氢气还原,测得反应后固体质量减少6.40g,另一份中加入500mL稀硝酸,固体恰好完全溶解,且同时收集到标准状况下NO气体4.48L,则所用硝酸的物质的量浓度为( )
| A、3.2mol/L |
| B、2.8mol/L |
| C、1.8mol/L |
| D、缺数据无法计算 |
用酒精灯加热下列溶液,蒸干后灼烧,所得固体质量最大的是( )
| A、20 mL 2 mol/L FeCl3溶液 |
| B、40 mL 1 mol/L NaHCO3溶液 |
| C、20 mL 1 mol/L Na2SO3溶液 |
| D、40 mL 2 mol/L NH4HCO3溶液 |
下列离子方程式书写正确的是( )
| A、在碘化亚铁溶液中通入足量氯气:2Fe2++2I-+2Cl2=2Fe3++I2+4Cl- | ||||
B、用铜电极电解氯化钠饱和溶液:2Cl-+2H2O
| ||||
| C、向硫酸亚铁溶液中通入H2S气体:Fe2++H2S=FeS↓+2H+ | ||||
| D、硫酸亚铁酸性溶液中加入过氧化氢:4Fe2++2H2O2+4H+=4Fe3++4H2O |
