题目内容
开发低碳能源是未来的发展趋势.
锂空气电池能够提供相当于普通锂离子电池10倍的能量,因此它是最有前途的电池技术.如图是锂空气电池放电和充电时的工作示意图.

(1)图Ⅰ中电极a是 极.
(2)用锂空气电池电解100mL 0.5mol?L-1 CuSO4溶液,当电池中消耗1.4g Li时,在阴极会析出 g铜.
(3)电池中间的固体电解质(含阳离子交换膜)还能阻止H2O、N2、O2等物质的通过,防止Li和这些物质反应.Li和水在常温下发生反应的化学方程式为 .
(4)当给图Ⅱ中的锂空气电池充电时,d极应接电源的 极,该电极的电极反应式为 .
锂空气电池能够提供相当于普通锂离子电池10倍的能量,因此它是最有前途的电池技术.如图是锂空气电池放电和充电时的工作示意图.

(1)图Ⅰ中电极a是
(2)用锂空气电池电解100mL 0.5mol?L-1 CuSO4溶液,当电池中消耗1.4g Li时,在阴极会析出
(3)电池中间的固体电解质(含阳离子交换膜)还能阻止H2O、N2、O2等物质的通过,防止Li和这些物质反应.Li和水在常温下发生反应的化学方程式为
(4)当给图Ⅱ中的锂空气电池充电时,d极应接电源的
考点:原电池和电解池的工作原理
专题:
分析:(1)电池放电时,属于原电池,电极a为Li电极,发生氧化反应,为负极;
(2)据电子守恒分析,1molLi失1mol电子,消耗1.4g Li时,转移电子
=0.2mol,据此分析;
(3)Li与水反应生成LiOH和氢气,据原子守恒和电子守恒书写化学方程式;
(4)电池充电时,属于电解池,相当于原电池的逆过程,d电极应发生氧化反应,氢氧根离子失去电子生成氧气与水.
(2)据电子守恒分析,1molLi失1mol电子,消耗1.4g Li时,转移电子
| 1.4g |
| 7g/mol |
(3)Li与水反应生成LiOH和氢气,据原子守恒和电子守恒书写化学方程式;
(4)电池充电时,属于电解池,相当于原电池的逆过程,d电极应发生氧化反应,氢氧根离子失去电子生成氧气与水.
解答:
解:(1)电池放电时,属于原电池,电极a为Li电极,发生氧化反应,为负极,故答案为:负;
(2)1molLi失1mol电子,消耗1.4g Li时,转移电子
=0.2mol,析出1mol铜,需得2mol电子,转移0.2mol电子,析出Cu0.1mol,但Cu只有0.05mol,所以析出3.2g,故答案为:3.2;
(3)Li与水反应生成LiOH和氢气,据原子守恒和电子守恒书写化学方程式为:2Li+2H2O═2LiOH+H2↑,故答案为:2Li+2H2O═2LiOH+H2↑;
(4)电池充电时,属于电解池,相当于原电池的逆过程,d电极应发生氧化反应,为阳极,解电源的正极,氢氧根离子失去电子生成氧气与水,电极反应式为:4OH--4e-═2H2O+O2↑,故答案为:正;4OH--4e-═2H2O+O2↑.
(2)1molLi失1mol电子,消耗1.4g Li时,转移电子
| 1.4g |
| 7g/mol |
(3)Li与水反应生成LiOH和氢气,据原子守恒和电子守恒书写化学方程式为:2Li+2H2O═2LiOH+H2↑,故答案为:2Li+2H2O═2LiOH+H2↑;
(4)电池充电时,属于电解池,相当于原电池的逆过程,d电极应发生氧化反应,为阳极,解电源的正极,氢氧根离子失去电子生成氧气与水,电极反应式为:4OH--4e-═2H2O+O2↑,故答案为:正;4OH--4e-═2H2O+O2↑.
点评:本题考查了原电池和电解池、化学方程式书写、电极反应式书写,题目难度中等.注意依据电子守恒解答问题.

练习册系列答案
相关题目
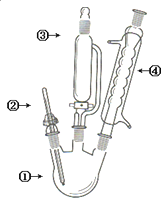 高中化学选修5《有机化学基础》第64页,有这样一个有机合成的装置图,有关下列仪器的名称和作用的叙述不正确的是( )
高中化学选修5《有机化学基础》第64页,有这样一个有机合成的装置图,有关下列仪器的名称和作用的叙述不正确的是( )| A、①三口烧瓶,用作反应器 |
| B、②为温度计,用于测量反应混合物的温度 |
| C、③为长颈漏斗,用于反应过程中添加反应液体 |
| D、④球形冷凝管,起冷凝、回流的作用,其冷水的进口在下方 |
下列物质能发生加成,加聚和缩聚反应的是( )
| A、C6H5-OH |
B、 |
| C、CH2=CH-COOH |
| D、HO-CH2-CH=CH-CH2-CH3 |
下列说法正确的是( )
| A、原电池是把电能转化为化学能的装置 |
| B、原电池中电子流出的一极是正极发生氧化反应 |
| C、原电池的两极发生的反应均为氧化还原反应 |
| D、形成原电池后,原电池中的阳离子向正极移动 |
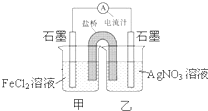 控制适合的条件,将反应Ag+Fe3+?Fe2++Ag+ 设计成如图所示的原电池.下列判断错误的是( )
控制适合的条件,将反应Ag+Fe3+?Fe2++Ag+ 设计成如图所示的原电池.下列判断错误的是( )| A、反应开始时,电子从甲中石墨经导线流向乙中石墨 |
| B、电流计指针为零时,上述反应的正反应速率等于逆反应速率 |
| C、电流计读数为零后,在甲中加入FeCl3固体,甲中石墨电极为负极 |
| D、电流计读数为零后,在甲中加入双氧水,甲中石墨电极反应式是Fe3++e-=Fe2+ |
下列各组离子在相应的条件下一定能大量共存的是( )
| A、与铝粉反应放出氢气的无色溶液中:NO3-、Mg2+、Na+、SO42- | ||
B、在
| ||
| C、水电离出的c(H+)=1×10-13mol/L的溶液中,K+、CO32-、Cl-、S2- | ||
| D、在pH=3的无色溶液中:Fe3+、C1-、NO3-、A13+ |
取一定质量的均匀固体混合物Cu、Cu2O和 CuO,将其分成两等份,取其中一份用足量的氢气还原,测得反应后固体质量减少6.40g,另一份中加入500mL稀硝酸,固体恰好完全溶解,且同时收集到标准状况下NO气体4.48L,则所用硝酸的物质的量浓度为( )
| A、3.2mol/L |
| B、2.8mol/L |
| C、1.8mol/L |
| D、缺数据无法计算 |
下列物质加入水中,显著放热的是( )
| A、熟石灰 |
| B、固体NaOH |
| C、固体NaCl |
| D、固体硝酸铵 |
