题目内容
某二元弱酸(简写为H2A)溶液,按下式发生一级和二级电离:H2A?H++HA-,HA-?H++A2-已知相同浓度时的电离度α(H2A)>α(HA-),设有下列四种溶液:
A.0.01mol?L-1的H2A溶液
B.0.01mol?L-1的NaHA溶液
C.0.02mol?L-1的HCl与0.04mol?L-1的NaHA溶液等体积混合液
D.0.02mol?L-1的NaOH与0.02mol?L-1的NaHA溶液等体积混合液,据此,填写下列空白(填代号):
(1)c(H+)最大的是 ,最小的是 .
(2)c(H2A)最大的是 ,最小的是 .
(3)c(A2-)最大的是 ,最小的是 .
A.0.01mol?L-1的H2A溶液
B.0.01mol?L-1的NaHA溶液
C.0.02mol?L-1的HCl与0.04mol?L-1的NaHA溶液等体积混合液
D.0.02mol?L-1的NaOH与0.02mol?L-1的NaHA溶液等体积混合液,据此,填写下列空白(填代号):
(1)c(H+)最大的是
(2)c(H2A)最大的是
(3)c(A2-)最大的是
考点:离子浓度大小的比较,弱电解质在水溶液中的电离平衡,盐类水解的原理
专题:
分析:0.02mol/L的HCl与0.04mol/L的NaHA溶液等体积混合液HCl与NaHA反应:NaHA+HCl=NaCl+H2A,所以C中相当于含有 0.01mol/LH2A 和0.01mol/LNaHA;
0.02mol/L的NaOH与0.02mol/L的NaHA溶液等体积混合NaOH+NaHA=Na2A+H2O 所以D中相当于含有0.01mol/LNa2A,
根据以上分析结合弱电解质的电离、盐的水解原理判断溶液中各粒子浓度大小.
0.02mol/L的NaOH与0.02mol/L的NaHA溶液等体积混合NaOH+NaHA=Na2A+H2O 所以D中相当于含有0.01mol/LNa2A,
根据以上分析结合弱电解质的电离、盐的水解原理判断溶液中各粒子浓度大小.
解答:
解:0.02mol/L的HCl与0.04mol/L的NaHA溶液等体积混合液HCl与NaHA反应:NaHA+HCl=NaCl+H2A,所以C中相当于含有 0.01mol/LH2A 和0.01mol/LNaHA;0.02mol/L的NaOH与0.02mol/L的NaHA溶液等体积混合NaOH+NaHA=Na2A+H2O 所以D中相当于含有0.01mol/LNa2A,
A、0.01mol/L的H2A溶液 B、0.01mol/L的NaHA溶液
C、0.01mol/LH2A 和0.01mol/LNaHA D、0.01mol/LNa2A
(1)因弱酸的一级电离为酸性的主要来源,明显只有A、C具有弱酸;而C中HA-会抑制同浓度弱酸的电离,故较小,只有D为正盐,水解程度最大,c(H+)最小,
故答案为:A;D;
(2)因C中电离比A小,留下的就比A大,故c(H2A) 最大;D中正盐二级水解生成弱酸最难,故c(H2A)最小,
故答案为:C;D;
(3)因正盐留下的A2-浓度必最大;弱酸H2A二级电离成A2-最难,
故答案为:D;A.
A、0.01mol/L的H2A溶液 B、0.01mol/L的NaHA溶液
C、0.01mol/LH2A 和0.01mol/LNaHA D、0.01mol/LNa2A
(1)因弱酸的一级电离为酸性的主要来源,明显只有A、C具有弱酸;而C中HA-会抑制同浓度弱酸的电离,故较小,只有D为正盐,水解程度最大,c(H+)最小,
故答案为:A;D;
(2)因C中电离比A小,留下的就比A大,故c(H2A) 最大;D中正盐二级水解生成弱酸最难,故c(H2A)最小,
故答案为:C;D;
(3)因正盐留下的A2-浓度必最大;弱酸H2A二级电离成A2-最难,
故答案为:D;A.
点评:本题考查了离子浓度大小比较、酸碱混合的定性判断,题目难度中等,试题知识点较多、综合性较强,明确酸碱混合的定性判断方法及溶液中离子浓度大小比较的方法.

练习册系列答案
相关题目
有a、b、c、d、e五种金属.已知(1)e的氧化产物比d的氧化产物氧化能力强;(2)a投入e的盐溶液中可得e的单质,而c投入e的盐溶液中却不能可得e的单质;(3)在以a、d为极板形成的原电池中(电解质溶液是稀硫酸),d极上发生还原反应;(4)电解含有a、b、c、e阳离子的盐溶液时,b离子最先在电极上放电,然后是e离子,a、c两种离子则不能在电极上放电;(5)c的单质与硫酸铜溶液反应可生产蓝色沉淀.推知五种金属的活动顺序为( )
| A、a、d、b、e、c |
| B、c、a、d、e、b |
| C、a、e、d、b、c |
| D、c、a、b、e、d |
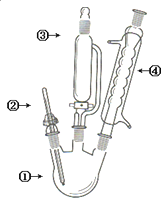 高中化学选修5《有机化学基础》第64页,有这样一个有机合成的装置图,有关下列仪器的名称和作用的叙述不正确的是( )
高中化学选修5《有机化学基础》第64页,有这样一个有机合成的装置图,有关下列仪器的名称和作用的叙述不正确的是( )| A、①三口烧瓶,用作反应器 |
| B、②为温度计,用于测量反应混合物的温度 |
| C、③为长颈漏斗,用于反应过程中添加反应液体 |
| D、④球形冷凝管,起冷凝、回流的作用,其冷水的进口在下方 |
某溶液中含有两种溶质NaCl和H2SO4,它们的物质的量之比为3:1.用石墨做电极电解该混合溶液时,根据电极产物,可明显分为三个阶段,下列叙述不正确的是( )
| A、阴极自始至终只有H2 |
| B、阳极先析出Cl2后析出O2 |
| C、电解最后阶段为电解水 |
| D、溶液pH不断增大,最后为7 |
11.9g金属锡跟100mL12mol?L-1HNO3共热一段时间.完全反应后测定溶液中c(H+)为8mol?L-1,溶液体积仍为100mL.放出的气体在标准状况下体积约为8.96L.由此推断氧化产物可能是(Sn的相对原子质量为119)( )
| A、SnO2?4H2O |
| B、Sn(NO3)4 |
| C、Sn(NO3)2 |
| D、Sn(NO3)2和Sn(NO3)4 |
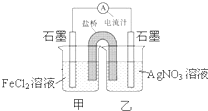 控制适合的条件,将反应Ag+Fe3+?Fe2++Ag+ 设计成如图所示的原电池.下列判断错误的是( )
控制适合的条件,将反应Ag+Fe3+?Fe2++Ag+ 设计成如图所示的原电池.下列判断错误的是( )| A、反应开始时,电子从甲中石墨经导线流向乙中石墨 |
| B、电流计指针为零时,上述反应的正反应速率等于逆反应速率 |
| C、电流计读数为零后,在甲中加入FeCl3固体,甲中石墨电极为负极 |
| D、电流计读数为零后,在甲中加入双氧水,甲中石墨电极反应式是Fe3++e-=Fe2+ |
 已知X、Y、Z、W四种短周期元素的原子序数依次增大,其中X与Y、Z、W所形成的常见化合物在常温下均呈气态,在周期表中Z与W左右相邻,Y的最高价氧化物的水化物与其氢化物反应生成盐,且Y的核电荷数与W的最外层电子数相同.请回答下列问题:
已知X、Y、Z、W四种短周期元素的原子序数依次增大,其中X与Y、Z、W所形成的常见化合物在常温下均呈气态,在周期表中Z与W左右相邻,Y的最高价氧化物的水化物与其氢化物反应生成盐,且Y的核电荷数与W的最外层电子数相同.请回答下列问题: