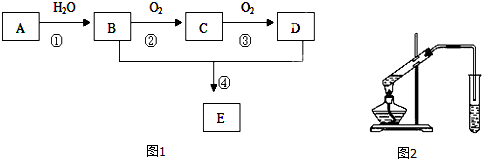
题目内容
4.在容积固定的密闭容器中,对于反应2SO2(g)+O2(g)?2SO3(g)△H<0.下列判断正确的是( )| A. | 增大反应体系的压强,平衡后SO2的浓度、转化率、体积分数都增加 | |
| B. | 当单位时间内消耗SO2的物质的量和生成SO3的物质的量相同时,反应达到平衡状态 | |
| C. | 充入SO3气体,体系压强增大,平衡向右移动 | |
| D. | 升高温度,平衡向左移动 |
分析 A.该反应为气体体积减小的反应,增大反应体系的压强,平衡正向移动;
B.单位时间内消耗SO2的物质的量和生成SO3的物质的量相同时,为正反应速率关系,不能体系正逆反应速率关系;
C.充入SO3气体,生成物浓度增大;
D.△H<0,为放热反应,升高温度,平衡逆向移动.
解答 解:A.该反应为气体体积减小的反应,增大反应体系的压强,平衡正向移动,则平衡后SO2的浓度、体积分数都减小,转化率增加,故A错误;
B.单位时间内消耗SO2的物质的量和生成SO3的物质的量相同时,为正反应速率关系,不能体系正逆反应速率关系,不能判定平衡,故B错误;
C.充入SO3气体,生成物浓度增大,平衡向左移动,故C错误;
D.△H<0,为放热反应,升高温度,平衡逆向移动,即向左移动,故D正确;
故选D.
点评 本题考查化学平衡移动,为高频考点,把握化学平衡移动的影响因素为解答的关键,侧重分析与应用能力的考查,注意温度、浓度、压强对平衡的影响,选项B为易错点,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
14.下列叙述正确的选项是( )
| A. | 对于一定条件下的某一可逆反应,用平衡浓度表示的平衡常数和用平衡分压表示的平衡常数,其数值不同,但意义相同,都随温度的升高而增大 | |
| B. | 结构式为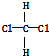 和 和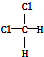 的物质互为同分异构体 的物质互为同分异构体 | |
| C. | 根据反应:NaA+CO2(少量)+H2O═HA+NaHCO3; 2NaB+CO2+H2O═2HB+Na2CO3,可以得出酸的强弱的顺序为:H2CO3>HA>HCO3->HB | |
| D. | 过硼酸钠晶体(NaBO3•4H2O)是一种优良的漂白剂,在70℃以上加热该晶体30.80克,反应后称量固体质量为27.20克,则该固体物质的化学式为NaBO3•H2O |
12.下列表述中正确的是( )
| A. | 放热反应在常温下均能自发进行 | |
| B. | 已知反应CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-802.3kJ/mol,说明甲烷的燃烧热为802.3kJ/mol | |
| C. | 反应热的大小与反应物和生成物的键能无关 | |
| D. | 含1molNaOH的溶液分别和含0.5molH2SO4、1mol HNO3的溶液反应,放出的热量相等 |
19.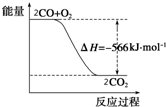 已知:2CO(g)+O2(g)═2CO2(g)△H=-566kJ•mol-1
已知:2CO(g)+O2(g)═2CO2(g)△H=-566kJ•mol-1
Na2O2(s)+CO2(g)═Na2CO3(s)+$\frac{1}{2}$O2(g)△H=-226kJ•mol-1
根据以上热化学方程式判断,下列说法正确的是( )
 已知:2CO(g)+O2(g)═2CO2(g)△H=-566kJ•mol-1
已知:2CO(g)+O2(g)═2CO2(g)△H=-566kJ•mol-1Na2O2(s)+CO2(g)═Na2CO3(s)+$\frac{1}{2}$O2(g)△H=-226kJ•mol-1
根据以上热化学方程式判断,下列说法正确的是( )
| A. | CO的燃烧热为566 kJ•mol-1 | |
| B. | 如图可表示由CO生成CO2的反应过程中能量变化的过程 | |
| C. | 2Na2O2(s)+2CO2(s)═2Na2CO3(s)+O2(g)△H=-452 kJ/mol | |
| D. | CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数为2 mol |
9.下列有关元素周期律的叙述中,正确的是( )
| A. | 氧化性强弱:F2<Cl2 | B. | 金属性强弱:Al<Na | ||
| C. | 酸性强弱:H2CO3<HNO3 | D. | 碱性强弱:NaOH<Mg(OH)2 |
16.常温常压下向2L的恒温密闭容器中投入2mol A和1mol B,发生可逆反应 3A(g)+2B(s)?2C(g)+D(g)△H=-a kJ/mol.5min后达平衡,测得容器中n(C)=0.8mol.则下列说法正确的是( )
| A. | 3v(A)=2v(C)=0.16 mol/(L•min) | |
| B. | 该可逆反应达平衡后,放出0.8a kJ的热能(假设化学能全转化为热能) | |
| C. | 升高温度,该平衡正向速率减小,故平衡逆向移动 | |
| D. | 使用催化剂或缩小容器体积,该平衡均不会移动 |
14.将V1ml 1.00mol/LHCl溶液和V2ml未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50ml),下列叙述正确的是( )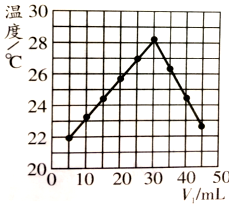

| A. | 实验操作时的环境温度为22℃ | |
| B. | 实验表明热能可转化为化学能 | |
| C. | 该实验表明有水生成的反应都是放热反应 | |
| D. | NaOH溶液的浓度约为1.50 mol/L |