题目内容
17.如图所示,将甲、乙两个装有不同物质的针筒用导管连接起来,将乙针筒内的物质压到甲针筒内,进行下表所列的不同实验.试回答下列问题:
| 实验序号 | 甲针筒内物质 | 乙针筒内物质 | 甲针筒的现象 |
| 1 | 10mL FeSO4溶液 | 10mLNH3 | 生成白色沉淀,后变色 |
| 2 | 5mL1mol/L FeCl3溶液 | 1mL1mol/L KSCN溶液 | |
| 3 | 10mL1mol/LAlCl3溶液 | 1mol/L NaOH | |
| 4 | 10mL2mol/LKAl(SO4)2溶液 | 1mol/LBa(OH)2溶液 |
(2)实验2甲针筒内的现象是:溶液变血红.
(3)实验3中,甲针筒内开始时的现象是:白色沉淀;若甲针筒内产生的沉淀的质量为0.39g,则则需向甲针筒内注入该NaOH溶液15 mL或35mL.
(4)实验4中,若持续向甲针筒内注入1mol/LBa(OH)2溶液,当生成沉淀的物质的量最大时,沉淀成分为BaSO4和Al(OH)3.(填化学式,下同).当生成沉淀的质量最大时,沉淀成分为BaSO4.
分析 (1)NH3与FeSO4溶液的水反应生成氨水,氨水电离出OH-与FeSO4溶液的+2价的铁离子反应生成Fe(OH)2,Fe(OH)2被空气中的氧气氧化生成氢氧化铁;
(2)FeCl3溶液与KSCN溶液反应,溶液变红色;
(3)AlCl3溶液中加入NaOH溶液,开始时生成氢氧化铝沉淀,当氢氧化钠过量时沉淀又逐渐减少,最后沉淀完全消失;10mL 1mol/L的AlCl3溶液中氯化铝的物质的量=0.01L×1mol/L=0.01mol,若Al元素都转化为氢氧化铝沉淀,则氢氧化铝沉淀的质量=0.01mol×78g/mol=0.78g>0.39g,说明有两种情况:一为沉淀不完全,只生成Al(OH)3沉淀;另一种情况为沉淀部分溶解,既生成Al(OH)3沉淀,又生成NaAlO2,结合方程式计算消耗氢氧化钠物质的量,进而计算需要氢氧化钠溶液体积;
(4)向KAl(SO4)2加Ba(OH)2溶液,开始发生反应SO42-+Ba2+=BaSO4↓,Al3++3OH-=A1(OH)3↓,Al3+完全沉淀,再继续滴加Ba(OH)2溶液,发生反应A1(OH)3+OH-=A1O2-+2H2O,SO42-+Ba2+=BaSO4↓.
解答 解:(1)氨气溶于水,发生反应:NH3+H2O?NH3•H2O,FeSO4+2NH3•H2O═Fe(OH)2↓+(NH4)2SO4,Fe(OH)2为白色沉淀,在空气中易被空气中的氧气氧化,发生反应:4Fe(OH)2+O2+2H2O═4Fe(OH)3,Fe(OH)3为红褐色,
故答案为:红褐;4Fe(OH)2+O2+2H2O=4Fe(OH)3;
(2)FeCl3溶液与KSCN溶液反应,溶液变红色,所以实验2甲针筒内的现象是溶液变血红;
故答案为:溶液变血红;
(3)AlCl3溶液中加入NaOH溶液,开始时生成氢氧化铝白色沉淀,当氢氧化钠过量时沉淀又逐渐减少,最后沉淀完全消失;
10mL 1mol/L的AlCl3溶液中氯化铝的物质的量=0.01L×1mol/L=0.01mol,若Al元素都转化为氢氧化铝沉淀,则氢氧化铝沉淀的质量=0.01mol×78g/mol=0.78g>0.26g,说明有两种情况:一为沉淀不完全,只生成Al(OH)3沉淀;另一种情况为沉淀部分溶解,既生成Al(OH)3沉淀,又生成NaAlO2,
n(Al(OH)3)=$\frac{0.39g}{78g/mol}$=0.005mol,
①若碱不足,由Al3++3OH-═Al(OH)3↓可知,
NaOH的物质的量为0.005mol×3=0.015mol,
加入NaOH溶液的体积为$\frac{0.015mol}{1mol/L}$=0.015L=15mL;
②沉淀部分溶解,既生成Al(OH)3沉淀,又生成NaAlO2,则:
Al3++3 OH-═Al(OH)3↓
0.01mol 0.03mol 0.01mol
Al(OH)3 +OH-═AlO2-+2H2O
(0.01-0.005)mol (0.01-0.005)mol
则消耗的碱的物质的量为0.03mol+(0.01-0.005)mol=0.035mol,
加入NaOH溶液的体积为$\frac{0.035mol}{1mol/L}$=0.035L=35mL;
故答案为:白色沉淀;15;35;
(4)向KAl(SO4)2加Ba(OH)2溶液,开始发生反应SO42-+Ba2+=BaSO4↓,Al3++3OH-=A1(OH)3↓,Al3+完全沉淀,此时生成的沉淀的物质的量最大,则生成沉淀的物质的量最大时,沉淀成分为BaSO4和Al(OH)3;继续滴加Ba(OH)2溶液,发生反应A1(OH)3+OH-=A1O2-+2H2O,SO42-+Ba2+=BaSO4↓,A1(OH)3减少,BaSO4增加,当硫酸根离子完全沉淀为BaSO4时,Al(OH)3完全溶解,此时生成沉淀的质量最大,沉淀成分为BaSO4;
故答案为:BaSO4和Al(OH)3;BaSO4.
点评 本题考查铁的化合物的性质、离子检验、离子方程式的有关计算等,难度中等,注意把握过量计算的方法以及常见元素化合物之间的反应,侧重于考查学生的计算能力和对基础知识的综合应用能力.

 25℃时,三种酸的电离常数为:
25℃时,三种酸的电离常数为:| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数K | 1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
(1)物质的量浓度为0.1mol/L的下列物质:a.Na2CO3、b.NaClO、c.CH3COONa、d.NaHCO3;pH由大到小的顺序是:abdc(填编号)
(2)常温下0.1mol/L的CH3COOH在水中约有1%发生电离,其溶液的pH=3,将该溶液加蒸馏水稀释,在稀释过程中,下列表达式的数据变大的是:BD.
A.c(H+) B.c(H+)/c(CH3COOH)
C.c(H+)•c(OH-) D.c(OH-)/c(H+)
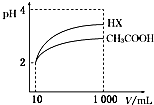
(3)体积为10mL pH=2的醋酸溶液与一元酸HX分别加蒸馏水稀释至1 000mL,稀释过程pH变化如图;则HX的电离平衡常数大于(填“大于”、“等于”或“小于”)醋酸的电离平衡常数;稀释后,HX溶液中水电离出来的c(H+)大于醋酸溶液水电离出来的c(H+)(填“大于”、“等于”或“小于”).
(4)25℃时,CH3COOH与CH3COONa的混合溶液,若测得混合液pH=6,则溶液中:c(CH3COO-)-c(Na+)=9.9×10-7mol/L(填准确数值).
| X | Y | ||
| Z | W | ||
| M |
| A. | X、Y、Z、W形成的单质中都含有非极性共价键 | |
| B. | 元素最高价氧化物水化物对应的酸性大小W>Z,简单离子半径大小 关系:W>Z>X | |
| C. | M的氢化物的沸点高于X的,化合物M2O3有氧化性和还原性 | |
| D. | 有“海洋元素”美誉的元素与M同周期与W同主族 |
| A. | K+、Na+、NO3-、CO32- | B. | Ba2+、Na+、Cl-、SO42- | ||
| C. | K+、Na+、Cl-、NO3- | D. | Na+、Mg2+、OH-、NO3- |
| A. | 乙烯 | B. | 乙炔 | C. | 苯 | D. | 四氯化碳 |
| A. | Fe和Al | B. | Fe和Zn | C. | Mg和Cu | D. | Mg和Zn |
| A. | 在该反应中,硫元素被氧化 | |
| B. | 上述反应中,Y为氮气 | |
| C. | 红色固体是氧化亚铜 | |
| D. | 98g H2SO4参与反应,必转移0.5NA个电子(NA为阿伏伽德罗常数的值) |
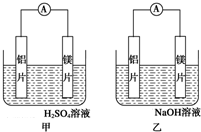 有甲、乙两位同学均想利用原电池反应检测金属的活动性顺序,两人均用镁片和铝片作电极,但甲同学将电极放入6mol•L-1的H2SO4溶液中,乙同学将电极放入6mol•L-1的NaOH溶液中,如图所示.
有甲、乙两位同学均想利用原电池反应检测金属的活动性顺序,两人均用镁片和铝片作电极,但甲同学将电极放入6mol•L-1的H2SO4溶液中,乙同学将电极放入6mol•L-1的NaOH溶液中,如图所示.