题目内容
2.由两种金属组成的混合物12g,与足量的稀H2SO4反应后,在标准状况下产生H2为11.2L,这种金属混合物可能是( )| A. | Fe和Al | B. | Fe和Zn | C. | Mg和Cu | D. | Mg和Zn |
分析 根据n=$\frac{V}{{V}_{m}}$计算出氢气的物质的量,假设金属都为+2价,金属与氢气的物质的量相等,根据M=$\frac{m}{n}$计算金属混合物的平衡相对原子质量,利用平均值法判断.
解答 解:标准状况下11.2L氢气的物质的量为:$\frac{11.2L}{22.4L/mol}$=0.5mol,
假设金属都为+2价,根据电子转移守恒可知,金属的物质的量为0.5mol,则金属混合物的平均相对原子质量为:$\frac{12}{0.5}$=24,
A.Fe的相对原子质量为56,当Al的化合价为+2价时,可看成其相对原子质量为$\frac{2}{3}$×27=18,平均原子量可以为24,故A正确;
B.Fe的相对原子质量为56,Zn的相对原子质量为65,二者平均相对原子质量介于56~65之间,平均相对原子质量不可能为24,故B错误;
C.Mg的相对原子质量为24,Cu不反应,其的相对原子质量看做无穷大,平均值不可能为24,故C错误;
D.Mg的相对原子质量为24,Zn的相对原子质量为65,二者平均相对原子质量介于24~65之间,二者的平均相对原子质量不可能为24,故D错误;
故选A.
点评 本题考查混合物的计算,题目难度中等,本题利用平均值法即可快速解答,注意化合价与相对原子质量的转化,试题培养了学生的化学计算能力.

练习册系列答案
相关题目
12.决定化学反应速率的主要因素是( )
| A. | 温度和压强 | B. | 催化剂 | ||
| C. | 参加反应物质的性质 | D. | 各反应物和生成物的浓度 |
13.离子键和共价键可能同时存在于同一化合物中.下列化合物中既存在离子键又存在共价键的是( )
| A. | KBr | B. | Na2O | C. | HBr | D. | NH4NO3 |
10.现将等物质的量的CuSO4、FeCl3、Zn放入盛有水的烧杯中充分反应,所得溶液中除SO42-、Cl-外,还含有的金属阳离子是( )
| A. | Zn2+、Cu2+、Fe3+ | B. | Zn2+、Cu2+、Fe2+ | ||
| C. | Zn2+、Fe2+、Cu2+、Fe3+ | D. | Zn2+、Fe3+ |
17.如图所示,将甲、乙两个装有不同物质的针筒用导管连接起来,将乙针筒内的物质压到甲针筒内,进行下表所列的不同实验.试回答下列问题:
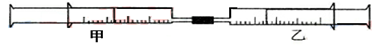
(1)实验1中,沉淀最终变为红褐色,写出沉淀变色的化学方程式4Fe(OH)2+O2+2H2O=4Fe(OH)3.
(2)实验2甲针筒内的现象是:溶液变血红.
(3)实验3中,甲针筒内开始时的现象是:白色沉淀;若甲针筒内产生的沉淀的质量为0.39g,则则需向甲针筒内注入该NaOH溶液15 mL或35mL.
(4)实验4中,若持续向甲针筒内注入1mol/LBa(OH)2溶液,当生成沉淀的物质的量最大时,沉淀成分为BaSO4和Al(OH)3.(填化学式,下同).当生成沉淀的质量最大时,沉淀成分为BaSO4.

| 实验序号 | 甲针筒内物质 | 乙针筒内物质 | 甲针筒的现象 |
| 1 | 10mL FeSO4溶液 | 10mLNH3 | 生成白色沉淀,后变色 |
| 2 | 5mL1mol/L FeCl3溶液 | 1mL1mol/L KSCN溶液 | |
| 3 | 10mL1mol/LAlCl3溶液 | 1mol/L NaOH | |
| 4 | 10mL2mol/LKAl(SO4)2溶液 | 1mol/LBa(OH)2溶液 |
(2)实验2甲针筒内的现象是:溶液变血红.
(3)实验3中,甲针筒内开始时的现象是:白色沉淀;若甲针筒内产生的沉淀的质量为0.39g,则则需向甲针筒内注入该NaOH溶液15 mL或35mL.
(4)实验4中,若持续向甲针筒内注入1mol/LBa(OH)2溶液,当生成沉淀的物质的量最大时,沉淀成分为BaSO4和Al(OH)3.(填化学式,下同).当生成沉淀的质量最大时,沉淀成分为BaSO4.
14.Cu2O和CuO组成的混合物中,Cu的质量分数为88%,则混合物中含Cu2O和CuO的物质的量之比( )
| A. | 5:1 | B. | 4:1 | C. | 3:2 | D. | 1:5 |