题目内容
7.下表是元素周期表的一部分,按要求完成各小题.| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅥⅠA | 0 | |
| 2 | ⑥ | ⑦ | ⑪ | |||||
| 3 | ① | ③ | ⑤ | ⑧ | ⑩ | |||
| 4 | ② | ④ | ⑨ |
(2)元素⑧的单质电子式

(3)元素⑤的原子结构示意图

(4)化学性质最不活泼的元素⑩(填元编号,下同),非金属性最强的元素是⑪.金属
性最强的单质②.
(5)①③⑤三种元素的最高价氧化物水化物中,碱性最强的NaOH.①③⑤三种元素的原子半径由大到小的顺序为Na>Mg>Al.
(6)某元素的最高价氧化物的水化物既能与酸反应生成盐和水又能与碱反应生成盐与水,该元素的最高价氧化物和盐酸反应的化学方程式为Al2O3+6HCl=2AlCl3+3H2O,与氢氧化钠溶液反应的化学方程式Al2O3+2NaOH=2NaAlO2+H2O.
分析 (1)由元素在周期表中位置,可知①为Na、②为K、③为Mg、④为Ca、⑤为Al、⑥为C、⑦为O、⑧为Cl、⑨为Br、⑩为Ar、⑪为F;
(2)⑧的单质为Cl2,分子中氯原子之间形成1对共用电子对;
(3)⑤为Al,原子核外有13个电子,有3个电子层,各层电子数为2、8、3;
(4)稀有气体原子最外层为稳定结构,化学性质最不活泼;同周期自左而右非金属性增强、金属性减弱,同主族自上而下非金属性减弱、金属性增强;
(5)金属性越强,最高价氧化物对应水化物的碱性越强;同周期自左而右原子半径减小;
(6)某元素的最高价氧化物的水化物既能与酸反应生成盐和水又能与碱反应生成盐与水,该元素为Al,其最高价氧化物为Al2O3,与盐酸反应生成氯化铝与水,与氢氧化钠溶液反应生成偏铝酸钠与水.
解答 解:由元素在周期表中位置,可知①为Na、②为K、③为Mg、④为Ca、⑤为Al、⑥为C、⑦为O、⑧为Cl、⑨为Br、⑩为Ar、⑪为F.
(1)①为Na元素,故答案为:Na;
(2)⑧为Cl,单质为Cl2,电子式为 ,故答案为:
,故答案为: ;
;
(3)⑤为Al,原子结构示意图为 ,故答案为:
,故答案为: ;
;
(4)稀有气体Ar原子最外层为稳定结构,化学性质最不活泼;同周期自左而右非金属性增强、金属性减弱,同主族自上而下非金属性减弱、金属性增强,故上述元素中F的非金属性最强,K的金属性最强,
故答案为:⑩;⑪;②;
(5)金属性Na>Mg>Al,金属性越强,最高价氧化物对应水化物的碱性越强,故NaOH的碱性最强,同周期自左而右原子半径减小,故原子半径:Na>Mg>Al,
故答案为:NaOH;Na>Mg>Al;
(6)某元素的最高价氧化物的水化物既能与酸反应生成盐和水又能与碱反应生成盐与水,该元素为Al,其最高价氧化物为Al2O3,与盐酸反应的化学方程式为Al2O3+6HCl=2AlCl3+3H2O,与氢氧化钠溶液反应的化学方程式为:Al2O3+2NaOH=2NaAlO2+H2O,
故答案为:Al2O3+6HCl=2AlCl3+3H2O;Al2O3+2NaOH=2NaAlO2+H2O.
点评 本题考查元素周期表与元素周期律的应用,难度不大,注意对元素周期律的理解掌握.

反应Ⅰ:CO(g)+2H2(g)?CH3OH(g)△H1
反应Ⅱ:2CH3OH(g)?CH3OCH3(g)+H2O(g)△H2
反应Ⅲ:2CO(g)+4H2(g)?CH3OCH3(g)+H2O(g)△H3
相关反应在不同温度时的平衡常数及其大小关系如下表所示
| 温度/K | 反应I | 反应II | 已知: K1>K2>K1′>K2′ |
| 298 | K1 | K2 | |
| 328 | K1′ | K2′ |
(1)反应Ⅰ的△S<0(填“>”或“<”);反应Ⅱ的平衡常数表达式为$\frac{[C{H}_{3}OC{H}_{3}][{H}_{2}O]}{[C{H}_{3}OH]}$,反应Ⅲ是放热反应(填“吸热”或“放热”).
(2)在合成过程中,因为有CO(g)+H2O(g)?CO2(g)+H2(g),反应发生,所以能提高CH3OCH3的产率,原因是此反应消耗了H2O(g)有利于反应II、III正向移动;同时此反应生成了H2,有利于反应I、III正向移动.
(3)如图1两条曲线分别表示反应I(按物质的量比:n(CO):n(H2)=1:2)中压强为0.1MPa和5.0MPa下CO转化率随温度的变化关系,计算压强为0.1MPa、温度为200℃时,平衡混合气中甲醇的物质的量分数是25%.
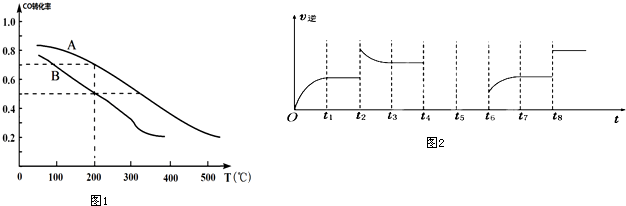
(4)反应Ⅲ逆反应速率与时间的关系如2图所示:
①试判断t2时改变的条件是增大生成物C浓度或升高温度.
②若t4扩大容器体积,t5达到平衡,t6时增大反应物浓度,请在图2中画出t4-t6的变化曲线.
| A. |  证明温度对平衡移动的影响 | B. |  吸收HCl尾气 | ||
| C. |  制备氢氧化亚铁 | D. |  验证溴乙烷消去反应生成了乙烯 |