题目内容
2.某同学在实验室用如图甲所示装置制取乙酸乙酯.
(1)请用化学反应速率和化学平衡解释浓硫酸在酯化反应中的作用浓硫酸作催化剂,加快反应速率,浓硫酸作吸水剂,吸收反应生成的水,使平衡右移,增加乙酸乙酯产率
(2)装置中通蒸汽的导管只能插到饱和碳酸钠溶液的液面上,其原因是防倒吸
(3)进行该实验时,应加入少量碎瓷片,目的是防暴沸
(4)随着温度升高,乙酸乙酯产率不断降低,其原因是该反应放热,乙酸和乙醇不断挥发,反应物利用率下降,故乙酸乙酯产率降低
(5)工业上分离粗产品中的乙醇、乙酸、乙酸乙酯,其流程图如下:
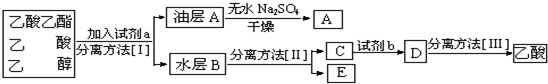
则试剂a是:饱和碳酸钠溶液,方法Ⅰ是分液,方法Ⅱ是蒸馏,
试剂b是浓硫酸,方法Ⅲ是蒸馏
(6)有甲、乙、丙三位同学,分别将乙酸与乙醇反应得到的酯(未用饱和Na2CO3溶液承接)提纯,在未用指示剂的情况下,他们都是先加NaOH中和过量的酸,然后用蒸馏法将酯分离出来.但他们的结果却不同:①甲得到了不溶于水的中性酯;②乙得到显酸性的酯的混合物;③丙得到大量水溶性物质.试分析产生上述各种现象的原因:甲同学加入的碱正好将过量的酸中和,所以蒸馏后得到中性酯②乙同学加入碱量不足,所以蒸馏出来的有过量的酸,得到显酸性的酯的混合物③丙同学加入的碱过量使生成的酯已经水解为可溶性的醇和钠盐
(7)某同学后来改进了实验装置,如图乙所示,其中,图乙中a装置的优点是使乙酸和乙醇冷却,回到容器中继续反应,提高反应物利用率.
分析 (1)乙酸与乙醇在浓硫酸作用下加热发生酯化反应,该反应为可逆反应,浓硫酸吸水利于平衡向生成乙酸乙酯方向移动;
(2)导管伸入液面下可能发生倒吸;
(3)进行该实验时,乙酸、乙醇沸点低,易暴沸,加入少量碎瓷片,目的是防暴沸;
(4)产率很低的原因有:乙酸和乙醇容易挥发,温度过高原料来不及反应就被蒸出;
(5)分离粗产品乙酸乙酯、乙酸和乙醇的混合物,加入饱和碳酸钠溶液,乙酸乙酯不溶于饱和碳酸钠,采用分液的方法即可,水层中的乙酸钠要用硫酸反应得到乙酸,再蒸馏得到乙酸;
(6)根据NaOH能与酸、酯发生反应以及NaOH量的不同反应进行的程度不同进行解答;
(7)图乙改进实验装置,a装置的优点是使乙酸和乙醇冷却,回到容器中继续反应,提高反应物利用率.
解答 解:(1)乙酸与乙醇在浓硫酸作用下加热发生酯化反应:CH3COOH+H18OCH2CH3 CH3CO18OCH2CH3+H2O,生成乙酸乙酯和水,
CH3CO18OCH2CH3+H2O,生成乙酸乙酯和水,
浓硫酸作催化剂,加快反应速率,该反应为可逆反应,浓硫酸吸水利于平衡向生成乙酸乙酯方向移动,增加乙酸乙酯产率,
故答案为:浓硫酸作催化剂,加快反应速率;浓硫酸作吸水剂,吸收反应生成的水,使平衡右移,增加乙酸乙酯产率;
(2)试管受热不均,右端试管中的导管伸入液面下可能发生倒吸,导管要插在饱和碳酸钠溶液的液面上,不能插入溶液中,目的是防止碳酸钠液体倒吸,便于乙酸乙酯流出,
故答案为:防倒吸;
(3)乙酸、乙醇沸点低,易暴沸,碎瓷片表面多孔,能引入汽化中心,防止液体暴沸,
故答案为:防暴沸;
(4)该反应放热,乙酸、乙醇都易挥发,温度升高,乙酸和乙醇不断挥发,使乙酸乙酯产率降低,
故答案为:该反应放热,乙酸和乙醇不断挥发,反应物利用率下降,故乙酸乙酯产率降低;
(5)分离粗产品乙酸乙酯、乙酸和乙醇的混合物,加入饱和碳酸钠溶液,实现酯与乙酸和乙醇的分离,分离油层和水层采用分液的方法即可;乙酸钠与乙醇分离采用蒸馏,分离方法Ⅱ是蒸馏,应该使用硫酸将乙酸钠转化成乙酸,然后通过蒸馏将乙酸分离,
故答案为:饱和Na2CO3溶液;分液;蒸馏;浓硫酸;蒸馏;
(6)①甲得到了不溶于水的中性酯,没有酸,说明所加NaOH溶液恰好中和了过量的酸;
②乙得到显酸性的酯的混合物,酸有剩余,说明是所加NaOH溶液不足未将酸完全反应;
③丙得到大量水溶性物质,说明没有酯,是因为所加NaOH溶液过量,酯发生水解,
故答案为:①甲同学加入的碱正好将过量的酸中和,所以蒸馏后得到中性酯 ②乙同学加入碱量不足,所以蒸馏出来的有过量的酸,得到显酸性的酯的混合物 ③丙同学加入的碱过量使生成的酯已经水解为可溶性的醇和钠盐;
(7)a装置为冷凝管,能使乙酸和乙醇冷却,回到容器中继续反应,提高反应物利用率,
故答案为:使乙酸和乙醇冷却,回到容器中继续反应,提高反应物利用率.
点评 本题考查了乙酸乙酯的制备方法及实验方案的设计与评价,题目难度中等,注意掌握乙酸乙酯的反应原理及实验室制法,明确正确的实验操作方法及浓硫酸、饱和碳酸钠溶液的作用为解答本题的关键,试题有利于提高学生的分析、理解能力及化学实验能力.

| 弱酸 | 醋酸 | 次氯酸 | 碳酸 | 亚硫酸 |
| 电离平衡常数 (25℃) | Ka=1.75ⅹ10-5 | Ka=2.98ⅹ10-8 | Ka1=4.3ⅹ10-7 Ka2=5.61ⅹ10-11 | Ka1=1.54ⅹ10-2 Ka2=1.02ⅹ10-7 |
| A. | 少量的CO2通入NaClO溶液中:CO2+H2O+2ClO-═CO32-+2HClO | |
| B. | 少量的SO2通入Na2CO3溶液中:SO2+H2O+2CO32-═SO32-+2HCO3- | |
| C. | 少量的SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO-═CaSO3↓+2HClO | |
| D. | 相同浓度的NaHCO3溶液与NaHSO3溶液等体积混合:H++HCO3-═CO2↑+2H2O |
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅥⅠA | 0 | |
| 2 | ⑥ | ⑦ | ⑪ | |||||
| 3 | ① | ③ | ⑤ | ⑧ | ⑩ | |||
| 4 | ② | ④ | ⑨ |
(2)元素⑧的单质电子式

(3)元素⑤的原子结构示意图

(4)化学性质最不活泼的元素⑩(填元编号,下同),非金属性最强的元素是⑪.金属
性最强的单质②.
(5)①③⑤三种元素的最高价氧化物水化物中,碱性最强的NaOH.①③⑤三种元素的原子半径由大到小的顺序为Na>Mg>Al.
(6)某元素的最高价氧化物的水化物既能与酸反应生成盐和水又能与碱反应生成盐与水,该元素的最高价氧化物和盐酸反应的化学方程式为Al2O3+6HCl=2AlCl3+3H2O,与氢氧化钠溶液反应的化学方程式Al2O3+2NaOH=2NaAlO2+H2O.
| A. | 煤经过气化和液化等物理变化可以转化为清洁燃料 | |
| B. | “地沟油”禁止食用,但可以用来制肥皂 | |
| C. | 合成纤维、人造纤维及碳纤维都属于有机高分子材料 | |
| D. | 用聚氯乙烯代替聚乙烯作食品包装袋,有利于节约成本 |

| A. | 图1:n (HCl)=1 mol,K2CO3逐步加入到HCl溶液中,在敞口容器中生成的气体 | |
| B. | 图2:n (NaOH)=1 mol,CO2逐步通入到NaOH溶液中反应生成的盐 | |
| C. | 图3:n (O2)=1 mol,高温下C和O2在密闭容器中的反应产物 | |
| D. | 图4:n (HNO3)=1 mol,Fe和稀HNO3反应生成的氧化产物(还原产物为NO) |
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | |||
| 4 | ⑧ | ⑨ |
(1)这九种元素分别是①C(填元素符号,下同)、②O、③Na、④Mg、⑤Al、⑥Cl、⑦Ar、⑧K、⑨Br,其中化学性质最不活泼的是Ar.
(2)在③④⑤三种元素的氧化物对应的水化物中,碱性最弱的是Al(OH)3(填化学式).
(3)①、②、③三种元素按原子半径由大到小的顺序依次为Na>C>O(填元素符号).
(4)⑥元素的氢化物是HCl(填化学式),该氢化物与④发生反应的化学方程式为2HCl+Mg=MgCl2+H2↑.
(5)⑧元素与⑥元素形成的化合物是KCl(填化学式),高温下灼烧该化合物时,火焰呈紫色.如何观察透过蓝色钴玻璃.
 电能与化学能之间的转化具有重要的使用价值.
电能与化学能之间的转化具有重要的使用价值.