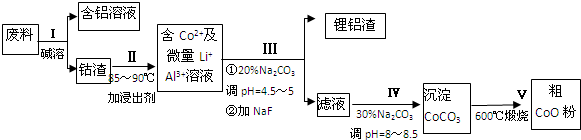
题目内容
16.某课外兴趣小组探究利用废铜屑制取CuSO4溶液,设计了以下几种实验方案:方案一:以铜和浓硫酸反应制备硫酸铜溶液.方案二:将废铜屑在空气中灼烧后再投入稀硫酸.和方案一相比,方案二的优点是不产生污染空气的SO2气体,制取等量的CuSO4溶液,消耗的硫酸量少;
方案二的实验中,发现容器底部残留少量紫红色固体,再加入稀硫酸依然不溶解,该固体为Cu.
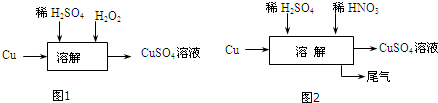
(1)方案三的实验流程如图1所示:溶解过程中有气体放出,该气体是O2.随着反应的进行,生成气体速度加快,推测可能的原因反应产生的Cu2+对H2O2分解有催化作用.
(2)设计实验证明你的推测取H2O2溶液,向其中滴加CuSO4溶液,观察产生气泡的速率是否加快.
(3)方案四的实验流程如图2所示:为了得到较纯净的硫酸铜溶液,硫酸和硝酸的物质的量之比应为3:2.
(4)对方案四进行补充完善,设计一个既能防止污染,又能实现物料循环的实验方案(用流程图表示).
分析 方案一:第一个方案中放出的有毒气体二氧化硫会造成对空气的污染;第二个方案铜和氧气加热生成氧化铜,氧化铜和硫酸反应产生硫酸铜和水,因此反应过程中没有污染物,且原料的利用率高,方案二的实验中,发现容器底部残留少量紫红色固体,为铜,不溶于稀硫酸;
方案二:(1)方案三的实验流程如图1中,双氧水反应氧化还原反应生成O2;随着反应的进行,生成气体速度加快,可能是反应产生的Cu2+对H2O2分解有催化作用;
(2)取H2O2溶液,向其中滴加CuSO4溶液,如果产生气泡的速率加快,则证明Cu2+对H2O2分解有催化作用,否则,没有;
(3)根据离子方程式,3Cu+2NO3-+8H+=3Cu2++2NO↑+4H2O,反应消耗2mol硝酸,生成3mol硫酸铜,故为了得到较纯净的硫酸铜溶液,硫酸和硝酸的物质的量之比应为3:2;
(4)设计实验方案时,为防止NO污染空气,应通入空气氧化NO为NO2,用水吸收后,生成HNO3再循环利用.
解答 解:方案一:第一个方案中放出的有毒气体二氧化硫会造成对空气的污染;第二个方案铜和氧气加热生成氧化铜,氧化铜和硫酸反应产生硫酸铜和水,因此反应过程中没有污染物,且原料的利用率高,方案二的实验中,发现容器底部残留少量紫红色固体,为铜,不溶于稀硫酸;
故答案为:不产生污染空气的SO2气体,制取等量的CuSO4溶液,消耗的硫酸量少;Cu;
方案二:(1)方案三的实验流程如图1中,双氧水反应氧化还原反应生成O2;随着反应的进行,生成气体速度加快,可能是反应产生的Cu2+对H2O2分解有催化作用,
故答案为:O2;反应产生的Cu2+对H2O2分解有催化作用;
(2)取H2O2溶液,向其中滴加CuSO4溶液,如果产生气泡的速率加快,则证明Cu2+对H2O2分解有催化作用,否则,Cu2+对H2O2分解没有催化作用;
故答案为:取H2O2溶液,向其中滴加CuSO4溶液,观察产生气泡的速率是否加快;
(3)根据离子方程式,3Cu+2NO3-+8H+=3Cu2++2NO↑+4H2O,反应消耗2mol硝酸,生成3mol硫酸铜,故为了得到较纯净的硫酸铜溶液,硫酸和硝酸的物质的量之比应为3:2,故答案为:3:2;
(4)设计实验方案时,为防止NO污染空气,应通入空气氧化NO为NO2,用水吸收后,生成HNO3再循环利用, ,故答案为:
,故答案为: .
.
点评 此题难度较大,依据题目的要求结合反应原理分析即可;分析一个反应的可行性要从多方面分析,如从反应的可行性,环保安全,操作简便,经济节能方面考虑.

 阅读快车系列答案
阅读快车系列答案| A. | 其他条件不变,减小容器体积,平衡不移动 | |
| B. | 其他条件不变,增大c(A),A的转化率增大 | |
| C. | 降低温度,v正增大,v逆减小 | |
| D. | v正(A)═2v逆(C) |
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅥⅠA | 0 | |
| 2 | ⑥ | ⑦ | ⑪ | |||||
| 3 | ① | ③ | ⑤ | ⑧ | ⑩ | |||
| 4 | ② | ④ | ⑨ |
(2)元素⑧的单质电子式

(3)元素⑤的原子结构示意图

(4)化学性质最不活泼的元素⑩(填元编号,下同),非金属性最强的元素是⑪.金属
性最强的单质②.
(5)①③⑤三种元素的最高价氧化物水化物中,碱性最强的NaOH.①③⑤三种元素的原子半径由大到小的顺序为Na>Mg>Al.
(6)某元素的最高价氧化物的水化物既能与酸反应生成盐和水又能与碱反应生成盐与水,该元素的最高价氧化物和盐酸反应的化学方程式为Al2O3+6HCl=2AlCl3+3H2O,与氢氧化钠溶液反应的化学方程式Al2O3+2NaOH=2NaAlO2+H2O.
| A. | 天然油脂--混合物 | B. | 氯气--非电解质 | ||
| C. | 二氧化氮--酸酐 | D. | 二氯甲烷--非极性分子 |

| A. | 图1:n (HCl)=1 mol,K2CO3逐步加入到HCl溶液中,在敞口容器中生成的气体 | |
| B. | 图2:n (NaOH)=1 mol,CO2逐步通入到NaOH溶液中反应生成的盐 | |
| C. | 图3:n (O2)=1 mol,高温下C和O2在密闭容器中的反应产物 | |
| D. | 图4:n (HNO3)=1 mol,Fe和稀HNO3反应生成的氧化产物(还原产物为NO) |
| A. | 标准状况下,11.2 L SO3中含有0.5NA个SO3分子 | |
| B. | 48g O3气体含有3NA个氧原子 | |
| C. | 在1L0.5mol•L-lFeCl3溶液中含有0.5NA个Fe3+ | |
| D. | 1.5 mol NO2与足量水反应,转移的电子数为1.5NA |
| A. | 稳定性:PH3>H2S>HCl | B. | 酸性:HClO4>HBrO4>HIO4 | ||
| C. | 非金属性:F>O>S | D. | 碱性:NaOH>Mg(OH)2>Al(OH)3 |
| A. | 锥形瓶 | B. | 试管 | C. | 分液漏斗 | D. | 250mL容量瓶 |