题目内容
20.下列计算结果正确是( )| A. | 向含有1mol AlCl3的溶液中加入足量NaOH溶液就会产生78g 白色沉淀 | |
| B. | 1 mol O2与金属Na充分反应,转移电子的数目为4 NA | |
| C. | 向0.1mol的碳酸钾固体中缓缓滴加0.2mol的稀盐酸会产生2.24L的CO2气体 | |
| D. | 标准状况下,用一充满干燥HCl气体的烧瓶做喷泉实验,当水充满整个烧瓶后(假设溶液不外溢),烧瓶内盐酸的物质的量的浓度为$\frac{1}{22.4}$mol/L |
分析 A.往AlCl3溶液中加入足量NaOH,产生NaAlO2无白色沉淀生成;
B.钠与氧气反应,不加条件生成过氧化钠,氧由0→-1价;
C.状况不知,无法求二氧化碳的体积;
D.设烧瓶的体积为VL,则烧瓶内盐酸的物质的量的浓度为$\frac{\frac{VL}{22.4L/mol}}{VL}$=$\frac{1}{22.4}$.
解答 解:A.往AlCl3溶液中加入足量NaOH,产生NaAlO2无白色沉淀生成,故A错误;
B.2Na+O2=Na2O2~2mole-
1 2,故转移2mole-即为2NA,故B错误;
C、状况不知,无法求二氧化碳的体积,故C错误;
D.设烧瓶的体积为VL,则烧瓶内盐酸的物质的量的浓度为$\frac{\frac{VL}{22.4L/mol}}{VL}$=$\frac{1}{22.4}$,故D正确.
故选D.
点评 本题考查铝离子在碱性溶液中的存在形式、根据反应原理计算气体的体积和物质的量浓度的计算,学生必须注意求气体体积时必须要知道状态,比较容易.

练习册系列答案
 初中暑期衔接系列答案
初中暑期衔接系列答案
相关题目
11.关于2mol二氧化碳的叙述中,正确的是( )
| A. | 摩尔质量为44g | B. | 质量为88g/mol | ||
| C. | 有4mol氧原子 | D. | 分子数为6.02×1023 |
12.炼金废水中所含CN-有剧毒,其性质与卤素离子相似,还原性介于I-与Br-之间,HCN为弱酸.下列说法不正确的是( )
| A. | CN-可以和稀硫酸反应生成HCN | B. | CN-可被Cl2氧化成(CN)28 | ||
| C. | 在水溶液中(CN)2可被F-还原 | D. | HCN的电子式为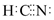 |
5.下列离子方程式中,正确的是( )
| A. | Na2O2溶于水产生O2:Na2O2+H2O═2Na++2OH-+O2↑ | |
| B. | 钠与CuSO4溶液反应:2Na+Cu2+═Cu↓+2Na+ | |
| C. | Ca(HCO3)2溶液与少量NaOH溶液反应:HCO3-+Ca2++OH-═CaCO3↓+H2O | |
| D. | Ba(OH)2溶液与稀H2SO4反应:Ba2++OH-+H++SO42-═BaSO4↓+H2O |
8.下列关于物质的性质和用途表述没有直接联系的是( )
| 选项 | 性质 | 用途 |
| A | 钠和钾的合金能导电 | 原子反应堆的导热剂 |
| B | 二氧化硫具有漂白性 | 漂白纸浆 |
| C | 镁燃饶时发出耀眼的强光 | 制作照明灯 |
| D | Al(OH)3加热易分解 | 塑料的阻燃剂 |
| A. | A | B. | B | C. | C | D. | D |
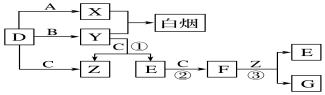
 A、B、C、D、E五种元素中只有E为金属元素,五种元素的原子叙述按B、D、C、A、E的顺序依次增大,D、C元素在元素周期表中位置相邻,在一定条件下,B的单质可以分别和A、.C、D的单质化合生成甲、乙、丙化合物,C的单质和D的单质化合物可得丁,戊、己、庚均为化合物.已知乙、丙每个分子中均含有10个电子,图为相互转化关系.
A、B、C、D、E五种元素中只有E为金属元素,五种元素的原子叙述按B、D、C、A、E的顺序依次增大,D、C元素在元素周期表中位置相邻,在一定条件下,B的单质可以分别和A、.C、D的单质化合生成甲、乙、丙化合物,C的单质和D的单质化合物可得丁,戊、己、庚均为化合物.已知乙、丙每个分子中均含有10个电子,图为相互转化关系.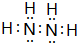 .
.
 如图是我校化学实验室浓盐酸试剂标签上的部分内容.
如图是我校化学实验室浓盐酸试剂标签上的部分内容.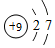 .
. .
.