题目内容
5.下列离子方程式中,正确的是( )| A. | Na2O2溶于水产生O2:Na2O2+H2O═2Na++2OH-+O2↑ | |
| B. | 钠与CuSO4溶液反应:2Na+Cu2+═Cu↓+2Na+ | |
| C. | Ca(HCO3)2溶液与少量NaOH溶液反应:HCO3-+Ca2++OH-═CaCO3↓+H2O | |
| D. | Ba(OH)2溶液与稀H2SO4反应:Ba2++OH-+H++SO42-═BaSO4↓+H2O |
分析 A.原子个数不守恒;
B.不符合反应客观事实;
C.氢氧化钠少量,反应生成碳酸钙、碳酸氢钠和水;
D.离子个数配比不符合物质结构组成.
解答 解:A.Na2O2溶于水产生O2,离子方程式:2Na2O2+2H2O═4Na++4OH-+O2↑,故A错误;
B.钠与CuSO4溶液反应生成氢氧化铜沉淀和硫酸钠、水,离子方程式:2Na+2H2O+Cu2+═H2↑+Cu(OH)2↓+2Na+,故B错误;
C.Ca(HCO3)2溶液与少量NaOH溶液反应,离子方程式:HCO3-+Ca2++OH-═CaCO3↓+H2O,故C正确;
D.Ba(OH)2溶液与稀H2SO4反应,离子方程式:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O,故D错误;
故选:C.
点评 本题考查了离子方程式的书写,明确反应实质是解题关键,注意离子反应遵循客观事实,遵循原子个数、电荷守恒规律,题目难度不大.

练习册系列答案
相关题目
16.把下列4种Na2S2O3的溶液分别加入4个盛有10mL 2mol•L-1硫酸的烧杯中,均加水稀释到50mL,此时,Na2S2O3和硫酸进行反应.其中出现沉淀最快的是( )
| A. | 20mL 3mol•L-1Na2S2O3的溶液 | B. | 20mL 2mol•L-1Na2S2O3的溶液 | ||
| C. | 10mL 4mol•L-1Na2S2O3的溶液 | D. | 10mL 2mol•L-1Na2S2O3的溶液 |
17.已知不同条件下,磷与硫酸铜可以发生如下两个反应:
①2P+5CuSO4+8H2O=5Cu+2H3PO4+5H2SO4
②11P+15CuSO4+24H2O=5Cu3P+6H3PO4+15H2SO4
下列叙述正确的是( )
①2P+5CuSO4+8H2O=5Cu+2H3PO4+5H2SO4
②11P+15CuSO4+24H2O=5Cu3P+6H3PO4+15H2SO4
下列叙述正确的是( )
| A. | 反应①中,氧化剂与还原剂的物质的量之比为2:5 | |
| B. | 反应②中,Cu3P既是氧化产物又是还原产物 | |
| C. | 反应②中,当有5mol CuSO4发生反应时,共转移电子10mol | |
| D. | 反应①中CuSO4做氧化剂,反应②中CuSO4作还原剂 |
14.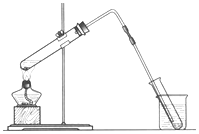 海洋是巨大的资源宝库,从海洋中可获得淡水、单质碘、食盐等物质.
海洋是巨大的资源宝库,从海洋中可获得淡水、单质碘、食盐等物质.
(1)如图是用海水制取少量蒸馏水的简易装置,其原理与课本中的实验原理完全相同.装置中使用了较长的玻璃管,其作用是导气冷凝,烧杯中还应盛装的物质是冰水.
(2)海带中含有丰富的碘,海带提碘可将海带灼烧、溶解、煮沸、过滤得含I-的滤液,滤液经酸化、氧化得含单质碘的溶液.回答下列问题:
?海带灼烧时用来盛装海带的仪器是坩埚(填仪器名称)
?已知KMnO4、H2O2、Cl2均可与I-反应生成I2,且KMnO4、H2O2、Cl2对应的生成物分别为Mn2+、H2O、Cl-.从绿色化学的角度将I-转化成I2,最好选择H2O2.
(3)海水晒盐得到的盐含有较多的杂质.某学习小组欲设计实验提纯粗盐.
?①若只除去其中的不溶性杂质,应经过的实验步骤是过滤、洗涤、干燥.
?②若要进一步除去上述粗盐中的可溶性杂质,应选择合理的除杂试剂.请填写表:
③为确保杂质除尽,所加试剂应适当过量.如何判断SO42-是否除尽?静置一段时间后,取少量上层清液于试管中,再滴加BaCl2溶液,若无沉淀生成,说明SO42-沉淀完全,反之未沉淀完全
④上述除杂试剂加入的先后顺序应满足的一般条件是Na2CO3溶液应加在BaCl2溶液之后
⑤按顺序加入上述除杂试剂过滤后,还应加入适量稀HCl,其目的是除去过量除杂试剂中的OH-和CO32-.
 海洋是巨大的资源宝库,从海洋中可获得淡水、单质碘、食盐等物质.
海洋是巨大的资源宝库,从海洋中可获得淡水、单质碘、食盐等物质.(1)如图是用海水制取少量蒸馏水的简易装置,其原理与课本中的实验原理完全相同.装置中使用了较长的玻璃管,其作用是导气冷凝,烧杯中还应盛装的物质是冰水.
(2)海带中含有丰富的碘,海带提碘可将海带灼烧、溶解、煮沸、过滤得含I-的滤液,滤液经酸化、氧化得含单质碘的溶液.回答下列问题:
?海带灼烧时用来盛装海带的仪器是坩埚(填仪器名称)
?已知KMnO4、H2O2、Cl2均可与I-反应生成I2,且KMnO4、H2O2、Cl2对应的生成物分别为Mn2+、H2O、Cl-.从绿色化学的角度将I-转化成I2,最好选择H2O2.
(3)海水晒盐得到的盐含有较多的杂质.某学习小组欲设计实验提纯粗盐.
?①若只除去其中的不溶性杂质,应经过的实验步骤是过滤、洗涤、干燥.
?②若要进一步除去上述粗盐中的可溶性杂质,应选择合理的除杂试剂.请填写表:
| 杂质 | CaCl2 | MgCl2 | Na2SO4 |
| 除杂试剂 | Na2CO3 | NaOH | BaCl2 |
④上述除杂试剂加入的先后顺序应满足的一般条件是Na2CO3溶液应加在BaCl2溶液之后
⑤按顺序加入上述除杂试剂过滤后,还应加入适量稀HCl,其目的是除去过量除杂试剂中的OH-和CO32-.
20.下列计算结果正确是( )
| A. | 向含有1mol AlCl3的溶液中加入足量NaOH溶液就会产生78g 白色沉淀 | |
| B. | 1 mol O2与金属Na充分反应,转移电子的数目为4 NA | |
| C. | 向0.1mol的碳酸钾固体中缓缓滴加0.2mol的稀盐酸会产生2.24L的CO2气体 | |
| D. | 标准状况下,用一充满干燥HCl气体的烧瓶做喷泉实验,当水充满整个烧瓶后(假设溶液不外溢),烧瓶内盐酸的物质的量的浓度为$\frac{1}{22.4}$mol/L |
9.能实现下列物质间直接转化的元素是( )
单质$\stackrel{O_{2}}{→}$氧化物$\stackrel{+H_{2}O}{→}$酸或碱$\stackrel{+NaOH或HCl}{→}$盐.
单质$\stackrel{O_{2}}{→}$氧化物$\stackrel{+H_{2}O}{→}$酸或碱$\stackrel{+NaOH或HCl}{→}$盐.
| A. | 硅 | B. | 硫 | C. | 铝 | D. | 铁 |
12.向实验室做完铝热反应(Al和氧化铁)后的混合物中,加入足量稀硫酸将其溶解,室温下向所得溶液中加入指定物质,反应后的溶液中主要存在的离子组正确的是( )
| A. | 通入过量Cl2:Cl-、Fe2+、SO42-、Al3+ | |
| B. | 加入过量NaOH溶液:Na+、AlO2-、SO42-、OH- | |
| C. | 加入过量氨水:Na+、NH4+、SO42-、AlO2- | |
| D. | 加入过量铜粉:NO3-、Fe3+、SO42-、Al3+ |