题目内容
11. 如图是我校化学实验室浓盐酸试剂标签上的部分内容.
如图是我校化学实验室浓盐酸试剂标签上的部分内容.甲同学现用该浓盐酸配制100mL 1mol•L-1的稀盐酸.可供选用的仪器有:①胶头滴管;②烧瓶;③烧杯;④药匙;⑤量筒;⑥托盘天平;⑦玻璃棒.请回答下列问题:
(1)配制稀盐酸时,还缺少的仪器有100mL容量瓶
(2)经计算,配制100mL 1mol•L-1的稀盐酸需要用量筒量取上述浓盐酸的体积为8.5mL(保留小数点后一位)
(3)对所配制的稀盐酸进行测定,发现其浓度小于1mol•L-1,引起误差的原因可能是BD
A.定容时俯视容量瓶刻度线
B.转移溶液后,未洗涤烧杯和玻璃棒
C.容量瓶在使用前未干燥,里面有少量蒸馏水
D.定容摇匀后发现液面低于容量瓶的刻度线,再加水至刻度线.
分析 (1)依据配制一定物质的量浓度溶液一般步骤选择需要仪器;
(2)根据c=$\frac{1000ρω}{M}$计算浓盐酸的物质的量浓度,根据稀释定律,稀释前后溶质盐酸的物质的量不变,据此计算需要浓盐酸的体积;
(3)分析操作对溶质物质的量、溶液体积的影响,根据c=$\frac{n}{V}$判断对溶液浓度的影响.
解答 解:(1)配制100mL 1mol•L-1的稀盐酸,可用量筒量取一定体积的浓盐酸,在烧杯中加水稀释,冷却后转移到100mL容量瓶中,并用玻璃棒引流,并洗涤烧杯,将洗涤液一并转移到容量瓶中,加入蒸馏水至刻度线2~3cm时,改用教头滴管定容,最后摇匀,装瓶,则还需要的仪器有100mL容量瓶;
故答案为:100mL容量瓶;
(2)浓盐酸的物质的量浓度为$\frac{1000×1.18×36.5%}{36.5}$mol/L=11.8mol/L,根据稀释定律,稀释前后溶质盐酸的物质的量不变,令需要浓盐酸的体积为V,则100mL×1mol•L-1=V×11.8mol/L,解得:V=8.5mL;
故答案为:8.5;
(3)A.定容时俯视容量瓶刻度线,液面在刻度线以下,溶液的体积偏小,所配溶液的浓度偏大,故A不符合;
B.转移溶液后,未洗涤烧杯和玻璃棒,少量HCl沾在烧杯内壁和玻璃棒上,移入容量瓶中HCl的物质的量偏小,所配溶液浓度偏小,故B符合;
C.容量瓶在使用前未干燥,里面有少量蒸馏水,对溶液的体积和溶质的物质的量无影响,所配溶液浓度无影响,故C不符合;
D.定容摇匀后发现液面低于容量瓶的刻度线,再加水至刻度线,溶液体积偏大,所配溶液浓度偏小,故D符合;
故选BD.
点评 本题主要考查了一定物质的量浓度溶液的配制以及误差分析,难度不大,在量取液体的体积时要注意仪器的精确度,往往和计算的结果不一致.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 在常温常压下,20mlNH3与60mlO2所含分子个数比为1:3 | |
| B. | 在化学反应中,1mol金属镁变为镁离子时失去电子数为NA | |
| C. | 在标准状况下,1mol水的体积为22.4L | |
| D. | 2molCaCl2中Cl-的数目为2NA |
| A. | 向Fe(OH)3胶体中滴加硫酸,会先出现红褐色沉淀,随后沉淀消失 | |
| B. | 在加入铝粉能放出氢气的溶液中:K+、NH4+、NO3-、Cl-一定能够大量共存 | |
| C. | 利用食醋除去热水瓶水垢中CaCO3的离子方程式为:CaCO3+2H+=Ca2++CO2↑+H2O | |
| D. | 除去乙酸乙酯中的少量乙酸:加入过量的NaOH溶液,静置分层后,除去水层 |
| A. | 向含有1mol AlCl3的溶液中加入足量NaOH溶液就会产生78g 白色沉淀 | |
| B. | 1 mol O2与金属Na充分反应,转移电子的数目为4 NA | |
| C. | 向0.1mol的碳酸钾固体中缓缓滴加0.2mol的稀盐酸会产生2.24L的CO2气体 | |
| D. | 标准状况下,用一充满干燥HCl气体的烧瓶做喷泉实验,当水充满整个烧瓶后(假设溶液不外溢),烧瓶内盐酸的物质的量的浓度为$\frac{1}{22.4}$mol/L |
| A. | H2S H2 CO2 | B. | SO2 Cl2 H2S | ||
| C. | O2 SO2 Cl2 | D. | HCl Cl2 SO2 |
| A. | 由被氧化的元素组成的反应物是氧化剂 | |
| B. | 在一个氧化还原反应中,氧化反应和还原反应同时发生 | |
| C. | 由化合态转变为游离态的变化一定是还原反应 | |
| D. | 氧化还原反应的实质是元素化合价的升降 |
过氧化氢对环境友好,性质多样,有很重要的研究和应用价值。
(1)实验室利用反应2H2O2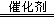 2H2O+O2↑可制备氧气。
2H2O+O2↑可制备氧气。
① 取等物质的量浓度等体积H2O2溶液分别进行下列实验,研究外界条件对该反应速率的影响,实验报告如下表所示。
序号 | 条件 | 现象 | 结论 | |
温度/℃ | 催化剂 | |||
1 | 40 | FeCl3溶液 | ||
2 | 20 | FeCl3溶液 | ||
3 | 20 | MnO2 | ||
4 | 20 | 无 | ||
实验1、2研究的是 对H2O2分解速率的影响。
实验2、3的目的是 。
实验中可以表明该反应速率差异的现象是 。
② 实验室用MnO2做该反应的催化剂,使用如右图所示装置的A部分制备O2,避免反应过于剧烈的操作是 。
(2)利用图21(a)和21(b)中的信息,按图21(c)装置(连能的A、B瓶中已充有NO2气体)进行实验。可观察到B瓶中气体颜色比A瓶中的___(填“深”或“浅”),其原因是_______________。