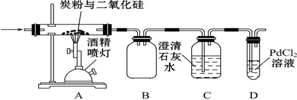
题目内容
19.常温下,pH=3的CH3COOH与pH=11的NaOH溶液反应,下列说法正确的是( )| A. | CH3COOH的浓度比NaOH溶液大,反应后醋酸过量呈酸性 | |
| B. | CH3COOH溶液中水的电离程度大于NaOH溶液中水的电离程度 | |
| C. | 反应后溶液中的离子浓度一定是c(CH3COO-)>c(Na+)>c(H+)>c(OH-) | |
| D. | 反应后的溶液中c(Na+)与c(CH3COO-)可能相等 |
分析 醋酸为弱酸,不能完全电离,pH值为3的CH3COOH和pH为11的NaOH溶液,两溶液中c(OH-)和c(H+)相等,所以CH3COOH的浓度比NaOH溶液大,由此分析解答.
解答 解:A、不知按何种体积之比反应,故A错误;
B、pH值为3的CH3COOH和pH为11的NaOH溶液,两溶液中c(OH-)和c(H+)相等,所以两者对水的电离抑制程度相同,所以水的电离程度相同,故B错误;
C、两者按何种体积之比参与反应,不知,所以离子浓度大小不知,故C错误;
D、两者反应溶液后溶液呈中性,根据电荷守恒可知:c(Na+)=c(CH3COO-),故D正确;
故选D.
点评 本题考查酸碱混合的定性判断,难度不大,注意醋酸为弱电解质的特点,为解答该题的关键.

练习册系列答案
相关题目
10.分子式为 C10H14且属于苯的同系物的同分异构体有______种( )
| A. | 20种 | B. | 21 种 | C. | 22 种 | D. | 23 种 |
7.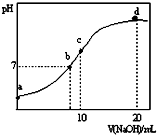 常温下,向20.00mL 0.1000mol•L-1 (NH4)2SO4溶液中逐滴加入0.2000mol•L-1NaOH时,溶液的pH与所加NaOH溶液体积的关系如图所示(不考虑挥发).下列说法不正确的是( )
常温下,向20.00mL 0.1000mol•L-1 (NH4)2SO4溶液中逐滴加入0.2000mol•L-1NaOH时,溶液的pH与所加NaOH溶液体积的关系如图所示(不考虑挥发).下列说法不正确的是( )
 常温下,向20.00mL 0.1000mol•L-1 (NH4)2SO4溶液中逐滴加入0.2000mol•L-1NaOH时,溶液的pH与所加NaOH溶液体积的关系如图所示(不考虑挥发).下列说法不正确的是( )
常温下,向20.00mL 0.1000mol•L-1 (NH4)2SO4溶液中逐滴加入0.2000mol•L-1NaOH时,溶液的pH与所加NaOH溶液体积的关系如图所示(不考虑挥发).下列说法不正确的是( )| A. | 点a所示溶液中:c(NH4+)>c(SO42-)>c(H+)>c(OH-) | |
| B. | 点b所示溶液中:c(NH4+)=c(Na+)>c(H+)=c(OH-) | |
| C. | 点c所示溶液中:c(SO42-)+c(H+)=c(NH3•H2O )+c(OH-) | |
| D. | 点d所示溶液中:c(NH3•H2O )>c(SO42-)>c(OH-)>c(NH4+) |
11.在一定温度下,将6mol C02和8mol H2充入2L恒容密闭容器中,发生反应:C02(g)+3H2(g)?CH30H(g)+H20(g)△H<O,一段时间后达到平衡.反应过程中测定的数据如下表.下列说法正确的是( )
| t/min | 1 | 4 | 8 | 11 |
| N(H2)/mol | 6 | 2.6 | 2 | 2 |
| A. | 反应前4min的平均速率v(C02)=0.45 mol/(L min) | |
| B. | 该温度下,该反应的平衡常数为0.5 | |
| C. | 其他条件不变,升高温度,反应达到新平衡时CH30H的体积分数增大 | |
| D. | 达到平衡时,H2的转化率为25% |
8.下列化学用语表达正确的是( )
| A. | 丙烯的球棍模型: | B. | 乙醇的比例模型: | ||
| C. | 乙烯的结构简式:CH2 | D. | 羟基的电子式: |
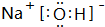 .
.